АКТИНОМИКОЗ, АКТИНОБАЦИЛЛЕЗ И РОДСТВЕННЫЕ ИМ ЗАБОЛЕВАНИЯ
Общее представление
Актиномикоз, актинобациллез, актиномицетома и нокардиоз - заболевания, не связанные между собой в терминах этиологии, эпидемиологии и терапии, но имеются серьезные основания для рассмотрения их вместе, так как они имеют общую историю и номенклатурное происхождение, а также сходные клинические и патологические проявления. Таксономические отношения между некоторыми из их причинных агентов также подобны.
История актиномикоза относится к ранним дням бактериологии. В 1877 немецкий ветеринар Otto Bollinger обнаружил, что хронические опухолеподобные поражения челюстей рогатого скота, о котором думали как своего рода саркоме, содержат маленькие, непрозрачные, желтоватые, зернистые частицы. Поскольку их структура походила на группу кристаллов, он назвал их "друзами". Друзы были образованы из похожих на нити, ветвящихся, грибоподобных структур, впоследствии охарактеризованных как грамм-положительные. Ботаник Carl O Harz (1877) полагал, что это новый вид плесени и предложил родовое и видовое обозначение Actinomyces bovis (лучистые грибы, от греческого aktis = луч; mykes = гриб) в связи с поразительным лучевым расхождением нитей в гранулах. Он также впервые представил для этой болезни термин "актиномикоз".
Первое детальное описание подобных патологических состояний у человека было опубликовано берлинским хирургом Джеймсом Исраелом (Israel) в 1878. Приблизительно десятилетием позже было установлено, что наиболее характерный человеческий патоген, теперь называемый Actinomyces israelii или Actinomyces gerencseriae, и патоген животных A. bovis являются анаэробами или, по крайней мере, факультативно анаэробными капнофилами - бактериями, которые лучше растут при высоком содержании CO2 (Bujwid 1889, Mosselman и Lienaux 1890). Только несколькими десятилетиями позже было установлено, что причинные агенты человеческого и "бычьего" актиномикоза - отдельные разновидности и что они являются истинными, хотя и нитевидными, бактериями, а не грибами, и что они были первыми представителями большой и гетерогенной группы Бактерий, теперь принадлежащей к порядками Actinomycetales и Bifidobacteriales подкласса Actinobacteridae в недавно определенном классе Actinobacteria (Stackebrandt, Rainey и Ward - Rainey 1997), но все еще часто упоминющиеся просто как "актиномицеты".
Lignieres и Spitz в 1902 г. описали новую болезнь крупного рогатого скота в Аргентине, клинически и патологически напоминающую бычий актиномикоз. Организмы, культивированные из соответствующих повреждений, были крошечные, короткие грам-отрицательные бактериальные палочки, которые заметно отличались от A. bovis. Из-за подобия между клиническими картинами из этих двух заболеваний возбудитель был сперва был назван "актинобацилла", а затем официально обозначен как Actinobacillus lignieresii (Brumpt 1910).
Прежде, чем установили анаэробный характер возбудителей актиномикоза человека и животных, было предпринято много попыток вырастить микроорганизмы в аэробных условиях. В обширном исследовании случаев актиномикоза у человека и крупного рогатого скота Bostroem (1891) изолировал на аэробном желатине или агаре нитевидные микроорганизмы, которые он расценил как патогенные и которым он дал название "Actinomyces bovis". Он также наблюдал остья зерна в центре актиномикотических повреждений и выделил культурально аналогичные аэробные нитевидные микроорганизмы из травы, зерна и других растительных материалов. В связи с этим Bostroem заключил, что трава или зерно являются экзогенными источниками актиномикотической инфекции и что жевание травы или зерна могло вызывать актиномикотические повреждения. Эта версия сохранялась длительное время даже после исследований Naeslund (1925, 1931) доказавшего, что A. israelii входит в состав врожденной микрофлоры полости рта человека, которая не встречается в окружающей среде, и, таким образом, источник актиномикоза всегда эндогенный.
К концу XIX-го столетия несколько исследователей идентифицировали патогенные аэробные актиномицеты, подобные возбудителям актиномикоза, изолированного Bostroem. Nocard (1888) описал аэробный нитевидный микроорганизм при "farcin du boeuf", болезни крупного рогатого скота на острове Гваделупа. Этот возбудитель получил название Nocardia farcinica Trevisan (1889). Подобная ветвящаяся бактерия была выделена из пораженного легкого у человека Eppinger (1891), и этот возбудитель был впоследствии обозначен как Nocardia asteroides Blanchard (1896). Другая нитевидная ветвящаяся бактерия, впервые обозначенная как "Streptothrix madurae", была изолирована Винсентом (Vincent, 1894) из опухолевидных поражений в Индии, носивших название "мадурская стопа". Этот организм был позже был назван "Nocardia madurae", а теперь известен как Actinomadura madurae (Lechevalier и Lechevalier 1970).
Начиная с сообщения Боллингера были описаны многочисленные дополнительных роды и разновидности аэробных и анаэробных актиномицетов. В своем большинстве это были безопасные обитатели окружающей среды или поверхностей тела человека и животных, и только некоторые могли выступать в роли патогена как у людей, так и у животных. Это относится не только к некоторым членам традиционных родов Actinomyces и Nocardia, но также и к разновидностям родов Bifidobacterium, Propionibacterium, Oerskovia, Gordonia, Rhodococcus, Tsukamurella, Actinomadura, Nocardiopsis, Streptomyces, Dermatophilus, Thermoactinomyces, Saccharopolyspora (Faenia), Saccharomonospora и Thermomonospora. Несмотря на возрастающий спектр патогенных актиномицетов, вряд ли было бы целесообразным добавить в дополнение к актиномикозу, нокардиозу, дерматофилозу многочисленные дальнейшие этиологические обозначения типа пропионибактериоз, родококкоз, тзукамуреллез (tsukamurellosis) и т.д. С другой стороны, ради ясности также не совсем верно было бы использовать термин "актиномикоз" для любого типа инфекции, вызываемых актиномицетами, как являлось обычной практикой в прошлом. Точно так же термин "нокардиоз" не охватывает ни все типы нокардиальных инфекций, ни инфекции, вызванные другим анаэробными актиномицетами. Таким образом, классические обозначения болезни "актиномикоз" и "нокардиоз" должны быть сохранены для обозначения определенного, клинически и этиологически заболевания с характерной клинической картиной.
Заболевания, вызываемые ферментирующими актиномицетами
Ферментирующие углеводы анаэробные или капнофильные актиномицеты, принадлежащие к семействам Actinomycetaceae, Propionibacteriaceae или Bifidobacteriaceae, выступают как этиологические агенты при разнообразных заболеваниях у человека и животных. Среди них, актиномикоз - наиболее характерное проявление заболевания. Другие заболевания, которые могут быть вызваны ферментирующими актиномицетами: зубной кариес и периодонтит, слезный каналикулит и другие глазные инфекции; инфекции, связанные с использованием внутриматочных контрацептивов и влагалищных маточных колец, другие воспалительные процессы у людей, такие как мастит, перитонит, плеврит, септический аборт, абсцессы и также самые различные гнойные поражения у животных.
Актиномикоз
Актиномикоз является подострым или, скорее, хроническим гранулематозным заболеванием, которое обычно вызывает нагноение и формирование абсцесса, а также имеет тенденцию образовывать свищевые ходы. Заболевание встречается у человека и животных. В дополнение к классическим патогенам A. bovis и A. israelii, актиномикотические поражения может вызвать разнообразное число видов других ферментативных актиномицетов. Большинство этих агентов принадлежит роду Actinomyces, но некоторые - члены рода Propionibacterium или Bifidobacterium. Кроме того, все типичные актиномикотические поражения, в дополнение к патогенным актиномицетам, содержат разнообразные бактерии. Таким образом, термин "актиномикоз" скорее определяет полиэтиологический воспалительный синдром, чем просто заболевание, относящееся к отдельному патогенному микроорганизму. Чтобы избегать представления дополнительных этиологических терминов и остаться бактериологически правильными, было предложено обозначить группу близко связанных воспалительных процессов термином "актиномикозы" в множественном числе (Schaal и Beaman 1984, Schaal 1996).
Актиномикоз у человека
Несмотря на значительные подобия в патологии, патогенезе и эпидемиологии, актиномикоз у человека и животных отличаются от друг друга по нескольким важным отношениям. За инфекции у человека и животных ответствены различные разновидности актиномицетов, и, кроме того, вовлечение в процесс костей редко наблюдают у человека, но очень часто - у животных (Slack и Gerencser 1975).
Клинические проявления актиномикоза
Начальные актиномикотические поражения развиваются обычно в тканях, смежных со слизистыми облочками, которые являются естественными средами обитания причинных агентов. Наиболее часто поражаются следующие участки: шейно-лицевой, грудной и абдоминальный. Редко - кожа, кости, или центральная нервная система (ЦНС), которая также может быть вовлечена в патологический процесс (Slack и Gerencser 1975, Pulverer и Schaal 1984, Schaal и Beaman 1984, Schaal и Pulverer 1984, Schaal 1996). После проникновения возбудителя в ткани инфекция имеет тенденцию медленно прогрессировать вне зависимости от естественных границ органа. Иногда наблюдают гематогенное распространение, при которых может быть вовлечена ЦНС (мозговой абсцесс) или естественные полости (эмпиема). Имеется характерная тенденция как к ремиссии, так и к обострению симптомов вне зависимости от проведения антибактериальной терапии. В связи с тем, что актиномикозы у человека- эндогенные инфекции, то трудно или невозможно определить их инкубационный период. Полагают, что до появления первых клинических признаков проходит приблизительно 4 недели, однако многочисленные сообщения говорят, что этот период может быть и намного более длинным или значительно короче.
Шейно-лицевой актиномикоз
В подавляющем большинстве случаев актиномикотическая инфекция поражает лицо, шею или и то и другое вместе - так называемую шейно-лицевую область (данные, собранные в Германии; см. в табл. 1), однако цифры могут различаться в разных географических областях, в особенности в США.
Таблица 1 Локализация актиномикозa у человека
ЛокализацияКол-во случаев%Шейно-лицевой324997,6Торакальный, включая грудную стенку431,3Абдоминальный, включая органы малого таза220,7Конечности, кожа220,7Мозг40,1Кровь (септицемия)20,06Всего3329100,0
Данные, собранные в Институте гигиены, университет Кельна, 1969-84 г, и в Институте медицинской микробиологии и иммунологии, университет Бонна, Германия, 1984-95 г.
Актиномикотическим поражениям часто предшествуют история кариеса и разрушения зуба, его удаления, перелома челюсти, периодонтального абсцесса, повреждения слизистой оболочки инородными телами (костные осколки, кости рыбы, остья травы или зерна) или нагноения миндалин. Следует помнить, что травматические факторы, местные или общие предрасполагающие условия - не обязательно имеют место во всех случаях или могут быть пропущены при сборе анамнеза.
При шейно-лицевом актиномикозе, по данным анализа 317 больных, наиболее часто в процесс были вовлечены следующие ткани: смежная с нижней челюстью (53.6 %), щека (16.4 %), подбородок (13.3 %), нижнечелюстная ветвь и угол (10.7 %), верхняя челюсть (5.7 %) и челюстной сустав (0.3 %) (Herzog 1981). Другие участки, которые поражаются реже: шея, сосцевидный отросток, пазухи, околоушная железа, щитовидная железа, язык, губы, носовая перегородка и уши (Slack и Gerencser 1975, Kingdom и Tami 1994). Непосредственное поражение кости и региональных лимфатических узлов случается очень редко, однако периостит и посттравматический остеомиелит с наличием ферментирующих актиномицетов встречается не так редко (11.7 % случаев, сообщенных Herzog 1981).
Первичные шейно-лицевые актиномикотические поражения представляют или острые, преимущественно одонтогенные, абсцессы, или очень острые формы панникулита, или как медленное формирующиеся твердые, красноватые или мертвенно бледные воспалительные инфильтраты (Lentze 1969, Pulverer и Schaal 1978, Schaal 1979, 1981, 1996). Принимая во внимание, что, хотя хронические инфильтраты обычно безболезненные, а острые формы инфекции - болезненные, они все могут вести к тризму жевательных мышц, когда процесс формируется вблизи височно-нижнечелюстного сустава.
Чтобы привести к быстрому и полному заживлению, только хирургического разреза и дренажа в подавляющем большинстве случаев бывает недостаточно. Острые и, особенно, хронические случаи имеют тенденцию не заживать без специфической терапии антибиотиками. В лучшем случае, имеет место временный регресс признаков, после чего через несколько недель или месяцев могут развиваться рецидивы. Чем более дольше сохраняются обе формы актиномикоза, тем скорее в обеих случаях развиваются аналогичные и очень характерные поздние признаки этого заболевания. Они включают: регресс и рубцевание центрального гнойного очага, прогрессирование твердых, безболезненных, мертвенно бледных инфильтратов на периферии, формирование многократных областей размягчения и формирования свищей. Последние появляются спонтанно или образуются в месте хирургического разреза и, вместе с многократными абсцессами, формируют в пораженной ткани многокамерную систему из полостей, которая плохо реагирует на обычную терапию, включая введение "стандартных" антибиотиков, и показывает явную тенденцию к рецидиву после временного регресса воспалительных признаков. Без лечения или при несоответствующем лечении шейно-лицевой актиномикоз медленно прогрессирует, даже через границы органа, и может стать угрожающим жизни при внедрении в полость черепа, средостение или при инвазии в крупные кровеносные сосуды (Herzog и другие, 1984). Выделения из свищей и гной из абсцессов обычно желтоватого цвета и по консистенции гуще серозного отделяемого и часто содержат частицы первоначально названные "друзы", или нередко упоминаемые как "серные гранулы".
Торакальный актиномикоз
Торакальные поражения при актиномикозе встречаются гораздо реже, чем шейно-лицевая форма. Формированию процесса обычно предшествует аспирация патогенного материала из полости рта, например, зубного налета или конкремента, содержимого крипты миндалины или инородного тела, загрязненного микрофлорой полости рта, включая патогенные актиномицеты. Иногда, эта форма заболевания развивается вследствие локального распространения шейно-лицевого процесса, перфорации диафрагмы из-за повреждения брюшной полости или гематогенным распространением из любого отдаленного очага инфекции (Slack и Gerencser 1975).
Прежде всего, торакальный актиномикоз может выглядеть как опухоль средостения или бронхопневмонический инфильтрат, некротическая пневмония или абсцесс легкого (Slack и Gerencser 1975, Schaal и Beaman 1984, Morrisи Sewell 1994). Рентгенограммы показывают отдельные плотные или множественные тени, в которых могут формироваться полости. В начале заболевания главные признаки - боль в груди, лихорадка, кашель с или без мокроты, потеря в весе, однако кровохарканье необычно. В дальнейшем инфекция может прогрессировать в эмпиему плевры, перикардит, или в поражение грудной стенки. Если диагноз поставлен поздно, или лечение неадекватно, последние признаки могут включать обширную подкожные абсцессы грудной стенки, паравертебральные или тазовые абсцессы, которые формируются в паху и опорожняются гноем, содержащим большое количество актиномикотических друз.
Абдоминальный актиномикоз
Актиномикотиченские поражения органов брюшной полости и аноректальной области достаточно редки (табл.1). Их развитие связано с острой перфорацией внутренних органов (аппендицит, дивертикулит, криптит, различные язвенные заболевания), хирургическими или другими травматическими повреждениями, включая поражения проглоченными костными осколками или рыбными костями.
Другой источник тазовых и брюшных актиномикотических инфекций не так давно был идентифицирован. Оказалось, что у 10-20% женщин с внутриматочными контрацептивами или влагалищными маточными кольцами матка и цервикальный канал колонизированы смешанной бактериальной флорой, которая включает потенциально патогенные ферментирующие актиномицеты (Gupta, Hollander и Frost 1976, Gupta, Erozan и Frost 1978, Eibach и другие. 1989, 1992, Schaal и Lee 1992, Chatwani и Amin-Hanjani 1994), а также другие, преимущественно анаэробные, бактерии (Schaal и Lee 1992). Они практически не встречаются у женщин, которые не используют эти устройства. Эта колонизация может служить начальным центром для развития агрессивного актиномикоза с поражением органов малого таза и может быть даже источником гематогенных метастатических печеночные или внутричерепных актиномикотических абсцессов (Gupta, Erozan и Frost 1978).
Начальные признаки абдоминального актиномикоза обычно невыраженные и неопределенные. Они включают: лихорадку, недомогание, слабость и боль, которые медленно, но прогрессивно нарастают. В ходе развития процесса он обычно напоминает медленно прогрессирующие опухоли подобные злокачественным процессам, типа рака желудка, толстой и прямой кишки, аноректальной области или шейки матки (Stein и Schaal 1984, Schaal 1985b, Ewig и другие. 1993, Alvarado-Cerna и Bracho-Riquelme 1994, Skoutelis и другие. 1995). Можно наблюдать большие подкожные абсцессы, обширные мертвенно бледные уплотнения, или фистулы, выделение из которых друз часто является первым характерным признаком заболевания (Schaal и Beaman 1984). Без эффективного лечения абдоминальный актиномикоз может распространяться на любую смежную ткань или орган, включая печень, селезенку, почку, маточные трубы, яичники, матку, яички, мочевой пузырь, прямую кишку, или брюшную стенку (Slack и Gerencser 1975, Khalaff, Srigley и Klotz 1995, Mмller-Holzner и другие. 1995).
Актиномикоз центральной нервной системы
Актиномикоз мозга и спинного мозга встречается очень редко, возможно, из-за более доступной теперь эффективной антибактериальной терапии, предупреждающей гематогенное или прямого распространение инфекции (Табл.1). Именно эти механизмы преимущественно ответственны за вовлечение ЦНС, особенно, когда первичное поражение расположено в легких или в брюшной полости (Slack и Gerencser 1975, Jamjoom, Jamjoom и al-Hedaithy 1994, Voisin и другие. 1998). Основное проявление актиномикоза ЦНС - мозговой абсцесс. Признаки зависят от локализации, и определяются скоростью развития абсцесса, степенью смещения или разрушения мозговой ткани. Основные симптомы - головная боль, повышение внутричерепного давления, очаговые симптомы, гемипарез, афазия, атаксия и патологические рефлексы (Slack и Gerencser 1975).
Актиномикоз костей и кожи
В отличие от некоторых животных, вовлечение костей редко встречается при актиномикозе у человека (табл.1). Процесс обычно обусловлен прямым распространением инфекции из прилегающих мягких тканей. Это ведет к периоститу, который стимулирует новый остеогенез, видимый на рентгенограммах. В начале заболевания можно наблюдать ограниченные участки разрушения кости, окруженные более плотной костной тканью. В таких случаях наиболее часто вовлекается нижняя челюсть, ребра и позвоночник. Хотя актиномикотические поражения других костей и были описаны, они не были подтверждены культуральным исследованием. Актиномикоз кожи встречается чрезвычайно редко (табл 1). Источнником являются, главным образом, раны, загрязненные слюной или зубным налетом, или человеческие укусы или травмы, полученные в кулачной драке. Может также происходить гематогенное распространение возбудителя в кожу. Клиническая картина кожного или раневого актиномикоз очень подобна шейно-лицевой форме.
Эпидемиология актиномикоза
Бактерии, которые выделяют из очагов актиномикотических повреждений у человека, по существу принадлежат к резидентной или транзиторной врожденной микрофлоре слизистых оболочек. Таким образом, кроме актиномикоза, возникающего вследствие человеческих укусов или повреждений в кулачной драке, заболевание всегда имеет эндогенное происхождение и поэтому не способно ни к эпидемическим вспышкам, ни передаче в обычном понимании.
Хотя спорадический актиномикоз случается по всему миру, тем не менее, встречаемость актиномикоза, кажется, изменяется от континента к континенту, от страны до страны, или даже от региона к региону, возможно отражая изменяющиеся стандарты ухода за зубами и различия в количестве и типах используемых антибиотиков. Такие факторы могут объяснять более низкую абсолютную и относительную встречаемость шейно-лицевого актиномикоза в США по сравнению с Европой, но более высокую распространенность торакальных и абдоминальных инфекций на североамериканском континенте.
На основании гистологических исследований Hemmes (1963) вычислил частоту актиномикотических инфекций в Нидерландах: 1 на 119000 жителей в год. Для области Кельн в Германии до 1969 г. Lentze (1969) сообщил о заболеваемости 1 на 83000. В дальнейшем эта заболеваемость была пересчитана для 1970-85 гг. и был определен интервал от 1 на 40000 (острые и хронические случаи вместе) до 1 на 80000 (только хронические случаи) в год (Schaal 1979). Это значительно выше, чем частота случаев актиномикоза в других областях Германии и в других европейских странах. Такие различия трудно объяснить, однако они скорее могут быть связаны с местными особенностями диагностики, чем с истинными эпидемиологическими различиями.
Давно известно (Slack и Gerencser 1975, Pulverer и Schaal 1978, Schaal 1981, Schaal и Beaman 1984) что типичный актиномикоз случается в 2,5-3,0 раза более часто у мужчин, чем у женщин. Кроме того, эпидемиологические данные, показывают, что неравное распределение заболевания по полу ограничено только больными половозрелого возраста. До полового созревания и в климактерическом периоде, актиномикоз распределен между полами равномерно (Pulverer и Schaal 1978, Schaal 1981). Это говорит о том, что заболевание может случаться во всех возрастных группах (Slack и Gerencser 1975, Pulverer и Schaal 1978, Schaal 1981). Среди наблюдаемых больных, самому молодому было 1,5 мес., а самому старому - 89 лет. Однако наиболее высокую частоту случаев актиномикоза наблюдали у мужчин в возрасте от 21 до 40 лет и у женщин от 11 до 30 лет (Pulverer и Schaal 1978, Schaal 1981, 1992, Schaal и Beaman 1984).
Патология и патогенез
Начальная стадия острого заболевания - воспалительный процесс, который ведет к формированию абсцесса или, если течение хроническое, развивается тканевая пролиферация и формируются множественные маленькие абсцессы. Более развитые процессы характеризуются рубцовой тканью в центре и с грануляциями на периферии, которая может включать множественные гнойные очаги или полости с множеством свищевых ходов. Редко, в случаях. когда в процесс вовлечена костная ткань, могут иметь место остеокластические и остеобластические изменения.
В гнойном очаге могут быть обнаружены друзы актиномицетов. Их обнаруживают в содержимом абсцесса или в выделениях из свищей приблизительно в 25% случаев, что имеет большую диагностическую ценность. Друзы имеют размеры до 1 мм в диаметре и видимы невооруженным глазом. Это желтоватые (с красноватым или к коричневатым оттенком) частички, напоминающие при небольших увеличениях цветную капусту. Под микроскопом после легкого сдавления между предметным и покровным стеклом можно видеть, что они составлены из различного числа сферических долей, которые представляют нитевидные актиномикотические микроколонии, сформированные in vivo и в целом образуют структуру типа цветной капусты. Ткани вокруг обычно инфильтрированы полиморфоядерными лейкоцитами.
Полностью раздавленные и окрашенные по Граму гранулы при большом увеличении показывают, что материал состоит из групп грам-положительных, переплетеных ветвящихся нитей мицелия. Окрашенные мазки могут также содержать разнообразное число других грам-положительных и грам-отрицательных палочек и кокков, которые представляют сопутствующую флору, а также многочисленные лейкоциты. Преимущественно в тканевом материале, и менее часто в гнойном отделяемом, можно наблюдать, что наконечники периферийных нитей в грануле закрыты булавоподобным слоем гиалинового материала, который может помочь отдифференцировать актиномикотические друзы от сходных частиц другого (микробного и немикробного) происхождения. Следует подчеркнуть, что термин "серные гранулы", довольно широко применяемый для обозначений актиномикотических друз, имеет отношение только к желтому цвету частиц, а вовсе не к высокому содержанию в них серы.
Основная естественная среда обитания всех патогенных для человека ферментирующих актиномицетов - полость рта здоровых взрослых людей, где они живут в значительных количествах. В пищеварительном и половом трактатах, однако, они, кажется, присутствуют только спорадически или в низких количествах. То же самый относится к полости рта младенцев перед прорезыванием зубов и уже беззубых взрослых. Это может объяснять, почему шейно-лицевым актиномикозом сравнительно реже болеют в очень молодом или старом возрасте.
Относительно низкая частота заболевания по сравнению с повсеместной встречаемостью возбудителя у взрослых людей видимо связана с необходимостью наличия тканевой инвазии, нежели простого дефекта слизистой оболочки. Такие условия скорее зависят от локальных повреждений ткани на участке внедрения, чем от дефекта функции иммунной системы в целом. В этом отношении, обязательная предпосылка для учреждения ферментирующих актиномицетов в тканях хозяина - наличие отрицательного окислительно-восстановительного потенциала, от которого зависят как патогенные актиномицеты, так и многие сопутствующие бактерии. Такое местное уменьшение кислородного потенциала может быть вызвано нарушением циркуляции крови вследствие общих нарушений кровообращения или сосудистого заболевания, травматическими повреждениями с размозжением тканей или внедрением инородных тел, или с некротической способностью других одновременно присутствующих микроорганизмов.
Эти так называемые "сопутствующие микроорганизмы" являются как бы пусковым механизмом актиномикотического процесса, производя локальные анаэробные условия. Кроме того, они усиливают относительно низкую инвазивную способность патогенных ферментатирующих актиномицетов, выделяя агрессивные ферменты типа гиалуронидаз и токсины. Таким образом, актиномикоз - это почти всегда синергическая микст-инфекция, в которой актиномицеты являются специфическим компонентом, или "ведущим" организмом, определяющим особенности клинического течения и характерную симптоматику заболевания. Состав сопутствующей микрофлоры изменяется от случая до случая, но она присутствует всегда и нередко определяет начальную клиническую картину и некоторые осложнения.
Разновидности ферментирующих актиномицетов, которые способны вызывать типичные актиномикотические поражения у человека, представлены в таблице 2. Наиболее часто были идентифицированы A. israelii и A.gerencseriae, но частота последнего явно недооценивается, потому что их стали отделялять от A. israelii начиная только с 1987 г. Третий возбудитель, который способен вызывать актиномикоз у человека - P. propionicum, но с этим видом сталкиваются довольно редко. Ранее классифицируемый как "Arachnia propionica" (Schaal 1986), он недавно было передан роду Propionibacterium на основании сходства последовательности 16S rРНК (Charfreitag, Collins и Stackebrandt 1988). Не всегда легко решить, являются ли другие актиномицеты, упомянутые в таблице 2, значимыми патогенами или они просто члены смешанной бактериальной флоры без особого значения.
Очень немного известно о факторах, которые могут объяснять патогенность актиномикоза, вызываемого ферментатирующими актиномицетами. Тем не менее, уже достаточно давно (Slack и Gerencser 1975) установлено, что Actinomyces spp. могут образовывать на своей поверхности ворсинчатый слой, который может напоминать волоски и который может способствовать адгезии возбудителя к клеткам хозяина (Figdor и Davies 1997).
Табл. 2. Разновидности ферментирующих актиномицетов, изолированных из очагов актиномикотических поражений у человека.
ВидыАктиномикотические поражения (n=1376)%Состояния, связанные с внутриматочными контрацептивами (n=114)%Глаза, органы слезоотделения (n=98)%Actinomyces israelii73.354.413.3A. gerencseriae*2.07.011.2A. naeslundii6.86.116.3A. viscosus4.916.719.4A. odontolyticus1.42.612.2A. meyeri0.63.50.0A. georgiae0.20.00.0A. neuii0.20.00.0Propionibacterium propionicum3.34.416.3Bifidobacterium dentium0.42.62.2Corynebacterium matruchotii0.90.02.2Rothia dentocariosa0.40.65.1Не идентифицированы5.72.02.0Всего100.0100.0100.0
Данные, собранные в институте гигиены, университет Кельна, 1969-84 гг, и в институте медицинской микробиологии и иммунологии, университет Бонна, 1984-95 гг.
* Примечание: различий между A. israelii и A. gerencseriae до 1987 г. обычно не производили.
Сопутствующее микрофлора в очагах актиномикоза может состоять как из аэробных, так как из анаэробных микробов. В более чем 50% случаев, исследованных Schaal, сопутствующие микроорганизмы состояли исключительно из анаэробов (Табл. 3). В остальных случаях были обнаружены как облигатные (строгие) анаэробы, так и факультативные анаэробы или аэробы. В среднем, в очаге присутствовали 2-4 разновидности сопутствующих бактерий, но в отдельных случаях определяли и до 10.
Таблица 3. Аэробные микроорганизмы, ассоциированные с ферментирующими актиномицетами, полученные из очагов поражения у человека
ВидыШейно-лицевой актиномикоз (n=3197) %Состояния, связанные с внутриматочными контрацептивами (n=81) %Нет аэробного роста47,232,1Коагулазо-негативные стафилококки27,914,8Staphylococcus aureus12,76,2альфа-гемолитический стрептококк11,211,1бета-гемолитический стрептококк4,911,1Streptococcus pneumoniae0,00,0Энтерококки0,016,1Кожные коринобактерии0,03,7Haemophilus spp.0,11,2Энтеробактерии2,513,6Gardnerella vaginalis0,06,2Неферментирующие0,20,0Дрожжи0,10,0Всего100,0100,0
По данным Schaal и Lee (1992).
Среди аэробных контаминантов (табл. 3) наиболее распространены были коагулазо-негативные стафилококки, Staphylococcus aureus, альфа-гемолитический и бета-гемолитический стрептококки. Анаэробная и капнофильная (микроаэрофильная) сопутствующая микрофлора гораздо более разнообразна и многочисленна. Синергичекие взаимодействия, вероятно, существуют между A. israelii и A. gerencseriae с Actinobacillus (Haemophilus) actinomycetemcomitans. Последний микроорганизм, название которого относится к его характерному сходству с актиномицетами, часто является причиной особенно хронического течения заболевания и малоэффективного лечения. Этот возбудитель может поддерживать воспалительный процесс со сходными симптомами даже после того, как химиотерапия полностью устраняет актиномицеты. Другие обычные компаньоны актиномицетов - черные пигментированные Bacteroidaceae (Prevotella spp., Porphyromonas spp.), непигментированные Prevotella и Bacteroides spp., Fusobacteria, так называемые микроаэрофильные стрептококки, которые принадлежат в основном к разновидности Streptococcus anginosus (milleri), пропионибактерии и Eikenella corrodens (Табл.4).
Таблица 4. Анаэробные микроорганизмы, ассоциированные с ферментатирующими актиномицетами, полученные из очагов поражения у человека
ВидыШейно-лицевой актиномикоз (n=3197) %Состояния, связанные с внутриматочными контрацептивами (n=81) %Actinobacillus actinomycetemcomitans22,92,5Микроаэрофильные стрептококки29,322,2Peptostreptococcus spp.18,229,6Черные пигментированные Bacteroidaceae37,758,0Непигментированные Bacteroides/Prevotella spp.14,069,1Fusobacterium spp.32,522,2Leptotrichia buccalis20,42,5Eikenella corrodens16,546,9Capnocytophaga spp.0,46,2Campylobacter/Selenomonas spp.0,13,7Propionibacterium spp.30,524,7Bifidobacterium spp.0,11,2Lactobacillus spp.0,542,0ВСЕГО100,0100,0
По данным Schaal и Lee (1992).
Очень мало известно относительно гуморального и клеточного иммунного ответов больных, страдающих от актиномикоза. Антитела против ферментатирующих актиномицетов могут быть обнаружены в человеческой сыворотке различными методами, включая методы иммунофлюоресценции и иммуноферментный анализ. Большинство этих антител реагируют более активно с антигенами A. naeslundii и A. viscosus, чем с A. israelii, A. gerencseriae, или P. propionicum. Кроме того, антитела главным образом связаны с наличием пародонтоза и редко - с предшествовавшим или существующим инвазивным актиномикозом. Таким образом, установлено, что антительный ответ при актиномикозе является незначительным или носит спорадический характер. Кроме того, антитела, вероятно, не имеют никакого защитного эффекта против актиномицетов, и их присутствие никак не является признаком самоизлечения от этого заболевания.
С другой стороны довольно давно было установлено (Lentze 1938), что иммунная система больных актиномикозом может быть стимулирована введением убитых формалином клеток или экстрактов клеток патогенных актиномицетов (актинолизат). Это приводит к формированию антительного ответа, который может быть измерен. Более важно, однако, что после введение актиномикотических антигенов возникает так называемая местная реакция, то есть временное усиление воспаления. Формирующийся после повторных введений иммунный ответ помогает преодолевать заболевание. Эти наблюдения дают основание для вакцинального лечения актиномикоза, который использовали перед антимикробной терапией (Lentze 1938, 1969).
Диагностика
Диагноз человеческого актиномикоза в основном основан на выделении и идентификации причинных агентов, потому что клинические симптомы часто вводят в заблуждение и гистопатология и серология низкоспецифична и низкочувствительна. Присутствие друз, которые иногда придают гною внешний вид манной каши, должно инициировать поиск актиномицетов. Однако учитывая, что только 25% образцов актиномикотического гноя содержит эти гранулы, их отсутствие не исключает диагноз актиномикоза.
Забор и транспортировка патогенного материала.
Подходящий для бактериологического анализа актиномикоза патматериал - гной, выделения из свищей, бронхиальный секрет, грануляция и биоптаты. Во время забора следует принять предосторожности против загрязнения врожденной, относящейся к слизистой оболочке, микрофлорой. Во всех случаях, когда это возможно, гной или ткань должны быть получены чрескожной пункцией. Для диагностики торакального актиномикоза, бронхиальный секрет должен быть получен транстрахеально. Исследование мокроты является недостоверным, поскольку она обычно содержит актиномицеты полости рта, включая патогенные разновидности. Трансторакальная чрескожная пункционная биопсия или чрескожная пункция подозрительных абдоминальных абсцессов - часто единственные средства получения удовлетворительных образцов патматериала для диагностики. Транспортировка образцов в бактериологическую лабораторию должна быть достаточно быстрой. Если длительная транспортировка неизбежна , нужно использовать специальные транспортные среды типа среды Стюарта, хотя ферментирующие актиномицеты менее восприимчивы к окислительному повреждению, чем строгие анаэробы.
Микроскопическое исследование
Когда присутствуют друзы, это позволяет быстро и сравнительно надежно поставить предварительный диагноз после осмотра при малом увеличении (д 100) актиномикотической гранулы, помещенной под покровное стекло и с внесенным в каплю 1% р-ром метиленового синего. Актиномикотические друзы проявляются как частички, подобные цветной капусте с неокрашенным центром и синей периферией, в которых лейкоциты и короткие нити, иногда с "дубинками", исходят от центра гранулы. Окрашенные по Граму мазки, полученные сдавлением гранул между двумя стеклами, показывают нитевидные, ветвящиеся, грам-положительные структуры, которые представляют патогенные актиномицеты, а также разнообразие других грам-отрицательных и грам-положительных бактерий, которые указывают на присутствие сопутствующих микроорганизмов. Наличие этих бактерий необходимо, чтобы отличить актиномикотические друзы от гранул, сформированных различными аэробными актиномицетами (Nocardia, Actinomadura, Streptomyces), которые никогда не содержат сопутствующую микрофлору. Прямая и непрямая иммунофлюоресценция для обнаружения специфических антител также может быть использована для определения разновидностей актиномицетов, находящихся в грануле, без выделения культуры.
Культуральная диагностика
Чтобы получить надежные результаты, целесообразно использовать прозрачные среды, чтобы чашки могли быть тщательно просмотрены с целью обнаружения характерных нитевидных колоний, и выращивать культуру, по крайней мере, 14 дней. Культуры могут быть исследованы каждые 2-3 дня без изменения анаэробных условий, еслис целью получения низкого кислородного потенциала используется метод Fortner (1928). Если используются анаэробные фляги или чашки, целесообразно сделать посев на две или три среды одновременно, чтобы исследовать их для определения роста актиномицетов после 3, 7 и 14 дней. Так как удаление чашек из анаэробной среды обычно останавливает дальнейший рост микроорганизмов, которым нужна длительная инкубация без изменений анаэробных условий.
Предварительные результаты культурального исследования получают через 2-3 дня, когда под микроскопом можно увидеть характерные паукообразные микроколонии A. israelii, A. gerencseriae или P. propionicum. Подтверждение предварительных микроскопических или ранних культуральных диагнозов однозначной идентификацией патогенной разновидности актиномицетов может занять 14 дней и более. Это необходимо, чтобы надежно выявить различия между ферментирующими актиномицетами и морфологически схожими контаминантами, полученные со слизистых оболочек больного, а также схожими аэробными актиномицетами родов Nocardia, Actinomadura и Streptomyces. Детальный бактериологический анализ сопутствующей микрофлоры также может быть полезен для выбора соответствующей терапии антибиотиками.
Молекулярные методы, типа генетических исследований или полимеразной цепной реакций (ПЦР), в настоящее время только разрабатываются и в будущем возможно смогут позволить осуществлять более быструю диагностику актиномикоза.
Серологическая диагностика.
Актиномикотическая инфекция не обязательно стимулируют гуморальный иммунный ответ, который можно обнаружить имеющимися лабораторными методами. Однако ни один из из использованных методов при большом разнообразии использованных антигенов не обеспечил удовлетворительных результатов из-за проблем с чувствительностью и специфичностью (Holmberg, Nord и Wadstrмm 1975, Holmberg 1981, Persson и Holmberg 1985).
Лечение
Хирургическое рассечение актиномикотических очагов и дренаж гнойного содержимого всегда является основой лечения актиномикоза. Однако известно, что даже радикальная операция часто только кончается временной редукцией симптомов и может сопровождаться одним или большим числом рецидивов. С целью преодоления этих проблем, в прошлом пытались применять вещества типа йодидов, тимола, сульфата меди, перекиси водорода, азотнокислого серебра, препаратов мышьяка, что, однако, не улучшило отдаленных результатов. Только подкожное введение убитых клеток актиномицетов (гетеровакцина Lentze 1938) показало определенную эффективность.
Прогресс в лечении актиномикоза появился тогда, когда стали доступны сульфаниламиды и пенициллин. Пенициллин был активен против патогенных актиномицетов in vitro и in vivo. Учитывая, что у многих больных эффект от терапии пенициллином был недостаточен или отсутствовал, часто рекомендовали лечение большими дозами пенициллина, по крайней мере, 3 месяца и до 12-18 месяцев (Harvey, Cantrell и Fisher 1957).
Плохой ответ на лечение пенициллином часто обусловлен наличием сопутствующих бактерий, которые являются пенициллин-резистентными. Кроме того, лекарственные средства плохо проникают через плотную ткань актиномикотических очегов и в друзы. Наконец, A. actinomycetemcomitans - обычно устойчивы к пенициллину, хотя и не производят бета-лактамаз. Таким образом, пенициллин вв лечении актиномикоза эффективен только тогда, когда не присутствует A. actinomycetemcomitans и когда сопутствующая микрофлора не содержит никаких продуцентов бета-лактамаз.
Аминопенициллины несколько более активны против патогенных актиномицетов, чем пенициллин, и, кроме того, они подавляют рост A. actinomycetemcomitans. Однако, учитывая, что они не стойки к действию бета-лактамаз, микроорганизмы, которые производят бета-лактамазы, могут мешать их терапевтической эффективности. Это редко имеет место при шейно-лицевом актиномикозе, но при торакальном и, особенно, абдоминальных инфекциях продуценты бета-лактамаз обычно присутствуют. Поэтому применяемые в настоящее время схемы лечения включают препараты, эффективные против актиномицетов и потенциала продуцентов бета-лактамаз типа S. aureus, грам-отрицательных анаэробов, и, в случаях абдоминального актиномикоза, Enterobacteriaceae.
Текущие рекомендации для антибиотикотерапии актиномикоза следующие: терапия выбора для шейно-лицевого актиномикоза: амоксициллин плюс клавулановая кислота или, возможно, ампициллин плюс сульбактам. Начальная доза - 2 г 3 раза в день амоксициллина плюс 0.2 г 3 раза в день клавулановой кислоты в день в течение 1 недели, и 1 г 3 раза в день амоксициллина плюс 0.1 г 3 раза в день клавулановой кислоты в день в течение другой недели. В редких случаях хронические инфекции шейно-лицевой области могут требовать до 4 недель лечения. Указанный лечебный режим может быть использован и при торакальном актиномикозе, но в этих случаях рекомендуется давать высокую дозу более длительно - в течение 3-4 недель. В длительно протекающих хронических случаях актиномикоза легких с целью увеличения тканевой концентрации может быть необходима повышенная доза ампициллина. В зависимости от сопутствующей флоры, также могут быть необходимы аминогликозиды, особенно когда имеет место стойкое присутствие Enterobacteriaceae типа Klebsiella spp. или Enterobacter spp. Последние вообще обычно присутствуют при абдоминальном актиномикозе. Терапия выбора для лечения этих инфекций - комбинация амоксициллина и клавулановой кислоты с метронидазолом (или клиндамицином) для строгих анаэробов плюс тобрамицин или гентамицин. Имипенем может быть подходящей альтернативой, но его для лечения актиномикотических инфекций используют пока довольно редко (Edelmann и другие. 1987, Yew и другие 1999).
Важно отметить, что ни метронидазол ни клиндамицин не могут быть использованы для лечения актиномикотической инфекции отдельно без добавленных антимикробных агентов, особенно аминопенициллинов, потому что клиндамицин почти неэффективен против A. actinomycetemcomitans (Niederau и другие. 1982, Schaal 1983, Schaal и другие. 1984), а метронидазол неактивен против патогенных актиномицетов (Schaal и Pape 1980, Niederau и другие 1982). Для лечения больных, имеющих аллергию на пенициллины, вместо аминопенициллинов можно использовать тетрациклины или цефалоспорины, однако клиническая эффективность этих препаратов намного меньше, чем таковая у аминопенициллинов или комбинации аминопенициллинов с ингибиторами бета-лактамаз.
Прогноз
Перед появлением в практике современных антибиотиков прогноз актиномикоза был сомнительным - ближе к неблагоприятному. Даже в настоящее время, больные, получающие неадекватную терапию, могут страдать от актиномикоза много лет и даже умирать от этого заболевания или его осложнений. Особенно это относится к торакальным и абдоминальным инфекциям, которые часто диагностируют лишь в последней стадии. Если диагноз установлен рано и антибиотикотерапия адекватна, то прогноз шейно-лицевого и кожного актиномикоза вообще хороший. Торакальные, абдоминальные и системные проявления, однако, остаются серьезной проблемой и требуют активного лечения.
Другие заболевания, вызываемые ферментирующими актиномицетами
Ферментирующие актиномицеты могут вызывать также некоторые другие заболевания, но они значительно отличаются от типичных актиномикотических поражений по клиническим проявлениям, прогнозу и лечению; поэтому они не должны проходить под термином "актиномикоз". Однако, некоторые из них не менее важны, чем актиномикоз, как с и медицинских, так и с экономических точек зрения.
Каналикулит и другие глазные инфекции
Наиболее частое заболевание, не связанное с травмой и вызываемое ферментирующими актиномицетами, - слезный каналикуллит с конъюктивитом и без конъюнктивита. Это заболевание обычно характеризуется желтоватыми к коричневатым сращениями в пределах канальца и гноем во внутреннем углу глаза. Наиболее важные причинные актиномицеты - P. propionicum, A. viscosus и A.israelii (Табл.2). Менее часто выделяют A. naeslundii, A. gerencseriae и Actinomyces odontolyticus (Schaal и Lee 1992). Сопутствующие бактерии присутствуют часто, но не всегда. Исключая наличие Streptococcus pneumoniae или Haemophilus influenzae в глазах и A. actinomycetemcomitans при шейно-лицевой форме актиномикоза, сопутствующая флора на обоих участках поражения очень схожа.
Помимо слезного каналикулита, глазные инфекции, вызываемые ферментирующими актиномицетами, могут также быть представлены как конъюнктивит, кератит, дакриоцистит, воспаление слизистых желез века и даже периобитальный абсцесс, гранулема или внутриглазная инфекция (Schaal 1986, Schaal и Lee 1992). Достоверный диагноз слезного каналикулита и других актиномикотическких поражений глаз осуществляется в соответствии с бактериологическими процедурами, упомянутыми выше. Удаление слезных сращиваний, которые обычно имеются при каналикуллите и местное применение антибиотиков почти всегда заканчивается быстрым излечением в случаях, когда имеется неинвазивный процесс. Инвазивные инфекции (абсцессы, гранулемы, внутриглазные инфекции) требуют системной терапии подходящими антибактериальными препаратами.
Состояния, связанные с внутриматочными контрацептивами (ВМК).
Как уже говорилось ранее в разделе по абдоминальному актиномикозу, матка и цервикальный канал женщин при наличии внутриматочных контрацептивов или влагалищных маточных колец часто колонизируются сложной бактериальной флорой, которая состоит из ферментативных актиномицетов и различных других аэробных и анаэробных бактерий (Eibach и другие. 1989, Schaal и Lee 1992). Эти микроорганизмы особенно избыточны непосредственно на нити ВМК в пределах цервикального канала, и очень напоминают характерную полимикробную флору актиномикотических поражений. Преобладающие актиномицеты при этих обстоятельствах - A. Israelii. Сравнительно часто обнаруживают A. viscosus. Другие разновидности также иногда выделяли (см. табл. 2). Сопутствующая флора в этих случаях очень схожа, но не идентична шейно-лицевому актиномикозу (см. табл. 3 и 4). Из аэробных бактерий в ВМК более или менее часто обнаруживают энтерококки, Enterobacteriaceae и Gardnerella vaginalis (табл.3). Несмотря на то, что анаэробы и капнофилы (микроаэрофилы) обычно присутствуют (табл.4), следует отметить намного более низкую частоту выделения A. actinomycetemcomitans и даже более низкая частота обнаружений фузобактерий в ВМК, чем шейно-лицевом актиномикозе, тогда как непигментированные разновидности Bacteroides и Prevotella, E. corrodens и лактобациллы более часто выделяют из ВМК. Присутствие ферментирующих актиномицетов и характерных сопутствующих бактерий на ВМК и в цервикальном канале не обязательно связано с симптомами агрессивной актиномикотической инфекции, которая нуждается в определенном лечении. Однако, приблизительно у 28% больных с актиномицетами в цервикальном канале или на ВМК определяли симптомы инфекции более нижних отделов полового трактата, а другие 26% имели инфекцию верхних отделов полового трактата (Eibach и другие. 1989, 1992). Симптомы типа лихорадки, болей или влагалищных выделений, обычно исчезают в пределах 4-8 недель после удаления ВМК, по крайней мере, при инфекциях нижних отделов полового тракта.
Когда типичные актиномицеты найдены на ВМК или в цервикальном канале, использование ВМК должно быть прекращено. После возвращения микрофлоры к нормальным показателям, ВМК можно снова использовать без увеличения риска развития актиномикоза половых органов.
Другие нагноительные инфекции
Ферментирующие актиномицеты могут быть причиной и других воспалительных процессов. Они включают фарингит, отит, уретрит, фунисит (воспаление пуповины) (Wright и другие. 1994), кожные и подкожные гнойные повреждения, абсцессы с или без связанной смешанной анаэробной флоры, эмпиемы и септицемия (Schaal 1986).
Эти инфекции могут вызывать не только "классические" Actinomyces spp., типа A. naeslundii, A. viscosus, A. odontolyticus и Actinomyces meyeri, но и некоторые другие Actinomyces spp. и Arcanobacterium haemolyticum, такие как: Actinomyces pyogenes, Actinomyces neuii subsp. neuii, Actinomyces neuii subsp. anitratus (Funke и другие. 1994), Actinomyces bernardiae (Funke и другие. 1995), Actinomyces radingae, Actinomyces turicensis (Wмst и другие. 1995), Actinomyces europaeus (Funke и другие. 1997) и Acinomyces graevenitzii (Ramos и другие. 1997). Кроме того, была описана как новая актиномицетоподобная разновидность Acinobaculum schaalii (Lawson и другие. 1997), которая была выделен от больных.
Заболевания, вызываемые аэробными актиномицетами
Аэробные актиномицеты с окислительным типом метаболизма углеводов составляют большую и очень гетерогенную группу нитевидных бактерий, которые недавно были поделены на подразделы Micrococcineae, Corynebacterineae, Micromonosporineae, Pseudonocardineae, Streptomycineae, Streptosporangineae, Frankineae и Glycomycineae порядка Actinomycetales в пределах недавно определенного класса Actinobacteria (Stackebrandt, Rainey и Ward - Rainey 1997). Они широко представлены в природе, в особенности в почве, и многие играют существенную роль в обороте органических останков. Только некоторые из этих микроорганизмов имеют медицинское значение как инфекционные агенты или как источники сильных аллергенов. Они принадлежат к семействам Cellulomonadaceae, Dermatophilaceae, Nocardiaceae, Gordoniaceae, Tsukamurellaceae, Pseudonocardiaceae, Streptomycetaceae, Nocardiopsaceae и Thermomonosporaceae. В зависимости от вовлеченной разновидности актиномицета, его места и механизма внедрения, а также иммунного статуса хозяина, аэробные актиномицеты могут вызывать разнообразные заболевания у человека и животных. Кроме того, как только недавно было установлено, эти микроорганизмы могут быть причиной внутригоспитальных инфекций, например, сепсиса, связанного с наличием катетера, или послеоперационных раневых инфекций. Наиболее обычные возбудители, ответственные за эти заболевания, принадлежат родам Nocardia и Actinomadura, но от больных также иногда выделяют и другие актиномицеты типа Amycolatopsis, Gordonia, Nocardiopsis, Pseudonocardia, Rhodococcus, Saccharothrix, Streptomyces и Tsukamurella (Schaal и Lee 1992, McNeil и Brown 1994).

БОТРИОМИКОЗ
Ботриомикоз - редко встречающееся бактериальное заболевание, которое клинически и гистологически напоминает инфекцию, обусловленную актиномицетами. Гистологически он представлен присутствием эозинофилов вокруг плотно спаянных микроорганизмов в сочетании с нагноительным очагом. Эта уникальная, но очень характерная гистологическая картина известна как феномен Сплендор-Хепли (Splendore-Hoeppli). Этот феномен наблюдают не только при ботримикозе или при актиномикозе, но и при других инфекциях, включая даже те, которые вызваны грибами и гельминтами. В случаях ботриомикоза гранулы напоминают "друзы" актиномицетов, но когда эти гранулы подвергаются культуральному исследованию, обнаруживают микроорганизмы типа Staphylococcus aureus, Escherichia coli и Pseudomonas aeruginosae. Другие микроорганизмы, такие как Proteus vulgaris и Streptococcus sp. также доложены как возможные причинные агенты ботриомикоза.
В 1870 году Bollinger впервые описал эозинофильный материал, который был выделен из легкого лошади. Тем не менее, в 1884, когда Rivota описал гранулы, подобные виноградной грозди и дал термин "ботриомикоз". Так как Rivota предполагал, что этот образец относится к грибковым инфекциям, термин "ботриомикоз" был взят от греческого "botris" (виноградная гроздь) + "mycosis" (грибы). В 1919 году Margou четко доказал бактериальную природу заболевания, выделив S. aureus из легочных поражений при ботриомикозе у лошади и воспроизведя заболевание экспериментально у морских свинок.
Хотя первые описания заболевания были у животных, они занимают до примерно 90 процентов случаев человеческого ботриомикоза. Заболевания у человека можно разделить на две большие группы: кожные и висцеральные. Кожный ботриомикоз встречается более часто и занимает примерно 75% всех описанных случаев ботриомикоза. Висцеральные поражения, напротив, довольно редки и описаны у больных с такими предлежащими заболеваниями как сахарный диабет, муковисцидоз и ВИЧ-инфекция.
Со времени описания первного случая у человека в 1913 году заболевние, известное как ботриомикоз остается трудно отличимым от актиномикоза. Патологически актиномкоз подобно ботриомикозу, может представлять феномен Splendore-Hoeppli. Два заболевания удовлетворительно выдающиеся, однако, когда производят окраску по Brown и Brenn ( на грам-положительные бактерии) и по Гомори-Грокотту - в образцах не обнаруживают актиномицеты. Рутинные окраска по Граму можут выявить причинный агент ботриомикоза. Окраска по Brawn-Hopps (на грам-отрицательные бактерии) обнаруживает грам-отрицательные палочки, которые при культуральном исследовоании дали рост P. aeruginosae.
Flynn, Felson и, затем, Neuhauser описали очевидность рентгенологически смежного вовлечения легочной такни, плевры и костей так сильно напоминающие актиномикоз, что позволило незамедлительно внести это заболевание в дифференциальный диагноз.
Развитие актиномикоза обычно нуждается в повреждении слизистых обоочек. Это повреждение может быть ятрогенным, например при хирургическом вмешательстве, вызванное инородным телом, например внутриматочным контрацептивом. Актиномикоз легких, однако, обычно связываают с аспирацией. Фактором, который вызывает формирование гранул при ботриомикозе пока неясны, но оба фактора, такие как сами ба4ктерии и макроорганизм несомненно вовлечены. Некоторые из ранних сообщений ботриомикоза представляют, что подобно актиномикозу, инородное тело необходимо для образования гранулы. Plaut описал больного сахарным диабетом, у которого центром внутрибрюшной инфекции явилось кукурузное рыльце. В случаев, описанном Klimmelstiel и Oden, таким инородным телом явилась рыбья кость.
Другие исследователи предположили, что размер инородной частицы и вирулентность организма определяет, будет ли бактерия продуцировать гранулы. В 1973 году Shults и соавт. Доложили о стафилококковом ботриомикозе обнаруженном в колонии мышей "свободной от патогенов". Они предположили, что только у определенных штаммом мышей образуются поражения мордочек, которые гистологически были идентифицированы как ботриомикоз. В добавок, они обнаружили, что большинство стафилококков ответственны за эти поражения переносясь специфичскими бактериофагами. Такое представление предполагает, что не только организм, но и определенные факторы в бактериях играют роль в формировании гранул. Далее они обнаружили, что большинство из пораженных животных имели инородные тела, связанные с этими поражениями.
Хотя и не очевидно, что иммунный статус организма играет роль при актиномикозе, наличие иммунодефицита вероятно предрасполагает к развитию ботриомикоза. Обзор литературы Brunken и соавт. показал, что многие больные имели иммунные нарушения. Paz и соавт. описали больного, у которого ботриомикоз легких явился первым проявлением хронической гранулематозной болезни, и они рекомендуют это учитывать при выявлении висцерального ботриомикоза. Семь случаев первичного легочного ботримикоза были описаны у больных с муковисцидозом, возможно вследствие поломки местной иммуной защиты. Эти факторы в комбинации с возможными нарушениями питания с потерей веса, могут быть также фактором, формирующими местную среду для развития ботриомикоза Несколько случаев ботриомикоза описаны у больных ВИЧ-инфекцией. Обычно у этих больных были представлены кожные поражения. Возможно падение числа CD4 является фактором "разрешающим" инфекцию у этих больных. Но даже в это группе больных ботриомикоз является довольно редким. В исследовании Brunken и соавт. большинство больных с ботриомикозом имели дефекты клеточного иммунитета, однако эти дефекты разрешались после терапии антибиотиками.
Абдоминальный актиномикоз (обзор литературы и описание двух случаев).
В.С.Митрофанов, М.А.Шевяков.
НИИ медицинской микологии им. проф. П.Н.Кашкина СПбМАПО.
Одно из самых значительных заблуждений в медицине связано с ошибочным присвоением бактериальному заболеванию названия «микоз». Речь идет об актиномикозе - бактериальном подостром или хроническом гранулематозном нагноительном заболевании, которое медленно прогрессирует с образованием множественных абсцессов и свищевых ходов.
Такая клиническая картина может быть вызвана различными видами актиномицетов – грам-положительных бактерий рода Actinomyces, которые могут ветвиться (образовывать мицелий). Последнее объясняет их сходство с грибами и служит поводом не только для оговорок в области терминологии, но и в ряде случаев для врачебных ошибок.
Известно, что основной возбудитель актиномикоза A. israelii входит в состав нормальной микробиоты полости рта и не встречается в окружающей среде. Таким образом, источник актиномикоза у человека всегда эндогенный.
Еще одна проблема, ассоциированная с современным течением актиномикоза – большая частота микст-инфекций в очаге поражения. Состав сопутствующей микробиоты непостоянен – она может состоять из аэробных и анаэробных штаммов. Как было показано в одном из крупномасштабных исследований [1] более чем в 50 % наблюдений сопутствующие микроорганизмы состояли исключительно из анаэробов. В остальных случаях были обнаружены как облигатные (строгие) анаэробы, так и факультативные анаэробы или аэробы. В среднем, в очаге воспаления присутствовали 2-4 вида сопутствующих бактерий, но в отдельных случаях число их достигало 10. Среди аэробов преобладали коагулазо-негативные стафилококки, золотистый стафилококк, α-гемолитический и β-гемолитический стрептококки.
Сопутствующая анаэробная и микроаэрофильная микробиота бывает гораздо более разнообразной и многочисленной. Синергические взаимодействия, вероятно, существуют между A. israelii, A. gerencseriae и Actinobacillus actinomycetemcomitans. Последний микроорганизм, название которого относится к его характерному сходству с актиномицетами, часто является причиной особенно затяжного течения заболевания и малоэффективного лечения. Этот возбудитель может поддерживать воспалительный процесс со сходными симптомами даже после того, как химиотерапия полностью устраняет актиномицеты.
Другие обычные «компаньоны» актиномицетов – представители семейства Bacteroidaceae (Prevotella spp., Porphyromonas spp., Bacteroides spp., Fusobacterium spp.) и так называемые микроаэрофильные стрептококки, которые принадлежат, в основном, к разновидности Streptococcus anginosus, Propionibacterium и Eikenella corrodens. При абдоминальных формах актиномикоза особенно характерно присутствие в очаге энтеробактерий, пигментированных Bacteroidacea, Bacteroides spp., Eikenella corrodens , Lactobacillus spp..
Актиномикотические поражения органов брюшной полости и аноректальной области встречаются относительно редко. Их развитие обычно связано с острой перфорацией внутренних органов (аппендицитом, дивертикулитом, криптитом, различными язвенными поражениями) и последствиями хирургических или других травматических повреждений, включая поражения проглоченными костными осколками.
Другой источник тазовых и брюшных актиномикотических поражений хорошо известен. Оказалось, что у 10-20% женщин с внутриматочными контрацептивами (ВМК) полость матки и цервикальный канал колонизированы смешанной микробиотой, которая включает потенциально патогенные актиномицеты, а также другие, преимущественно анаэробные, бактерии.
Описаны актиномикотические поражения, пищевода, желудка [2] (в частности, интрамуральный актиномикоз желудка [3] ), печени и актиномикотический холецистит [4]. В обзоре описанных случаев актиномикоза пищевода у 5 больных из 8 был диагностирован СПИД, отмечено сочетание кандидоза и актиномикоза пищевода [5]. Но чаще всего в процесс вовлекается илеоцекальный отдел кишечника.
Клиническая картина абдоминального актиномикоза не имеет патогномоничных признаков и чаще всего напоминает опухоль. Среди объективных и лабораторных признаков гастроэнтерологу чаще всего приходится отмечать у больного жалобы на умеренный нарастающий абдоминальный болевой синдром, слабость, повышение температуры, пальпируемый инфильтрат в брюшной полости, определяются воспалительные сдвиги в клиническом анализе крови. Часто первым характерным признаком заболевания является образование больших плотных подкожных абсцессов с формированием свищевых ходов и выделением густого гноя, в котором можно обнаружить друзы (зерна) актиномицетов.
Компьютерная томография при актиномикозе неспецифична, однако актиномикоз можно предполагать при наличии негомогенных инфильтратов. При УЗИ печени, например, выявляют единичные или множественные образования овальной формы неоднородной структуры за счет участков пониженной и повышенной плотности [6].
Стандарт диагностики актиномикоза – обнаружение при гистологическом исследовании материалов из очага воспаления так называемой «друзы» - тканевой формы актиномицетов, окруженных воспалительным валом из клеток фагоцитарного ряда. Тем не менее желательно добиваться идентификации возбудителя при культуральном исследовании отделяемого свищей и интраоперационого материала. Особо необходимо подчеркнуть важность определения всего спектра возбудителей, участвующих в инфекционном процессе.
Без эффективного лечения актиномикоз кишечника может распространяться на любую смежную ткань или орган, включая печень, селезенку, почку, маточные трубы, яичники, матку, яички, мочевой пузырь, прямую кишку или брюшную стену.
Основные правила назначения терапии при абдоминальном актиномикозе – выбор препарата с учетом спектра участников микст-инфекции и адекватная продолжительность курса химиотерапии.
В период до открытия антибиотиков основным методом лечения актиномикоза являлось иссечение пораженных участков и дренаж гнойного содержимого из очагов, однако случаи рецидивов были нередкими. Значительные изменения в терапию этого заболевания внесло открытие пенициллина, который стали применять для лечения актиномикоза с 1945 года. Расхождения в оценке эффективности пенициллина разные авторы поначалу объясняли различной чувствительностью Actinomyces spp. по отношению к нему.
Следует отметить, что в целом Actinomyces spp. чувствительны к широкому диапазону антимикробных средств. Они высоко чувствительны к бета-лактамным антибиотикам, а также в большей или меньшей степени к тетрациклинам, хлорамфениколу, макролидам, линкомицину, фузидиевой кислоте и ванкомицину. Обычно актиномицеты устойчивы к аминогликозидам, пептидным антибиотикам (полимиксинам и др.), метронидазолу, а также к фторхинолонам, включая так называемые «новые фторхинолоны», например левофлоксацину и спарфлоксацину [7]. Резистентность актиномицетов к антибиотикам в процессе лечения обычно не развивается.
Долгое время стандартом терапии актиномикоза считали длительное (6-8 мес.) лечение высокими дозами бензилпенициллина (до 18-20 млн. ЕД в сутки). Известно, что бензилпенициллин активен против актиномицетов как in vitro, так и in vivo, однако отмечено много рецидивов заболевания или случаев неполного эффекта даже при длительных курсах лечения высокими дозами. Это связано, прежде всего, с ограничением эффективности бензилпенициллина из-за присутствия в очаге различных контаминирующих бактерий с разным спектром чувствительности к нему.
Продукция β-лактамаз синнергичной микробиотой, такой как Bacteroides spp. или стафилококками, может защищать от воздействия бензилпенициллина даже те бактерии, которые к нему чувствительны. Actinobacillus actinomycetemcomitans, присутствующие почти в трети случаев актиномикотических поражений, также обычно резистентны к бензилпенициллину, хотя и не продуцируют β-лактамаз.
Современной основой лечения актиномикоза являются аминопенициллины. Они несколько более активны против патогенных актиномицетов, чем бензилпенициллин, и к тому же способны ингибировать Act. actinomycetemcomitans, обычно резистентные к бензилпенициллину [8].
Тем не менее, аминопенициллины не устойчивы к β-лактамазам и наличие продуцентов этих ферментов может существенно снижать их терапевтический эффект. Продуценты β-лактамаз, такие как Bacteroides fragilis, B. thetaiotaomicron или Staphylococcus aureus, редко встречаются при шейно-лицевом актиномикозе. Напротив, при торакальном и, особенно, при абдоминальном актиномикозе такие β-лактамазопродуцирующие контаминирующие микроорганизмы обычно присутствуют.
При лечении хронических форм актиномикоза прежде всего необходимы высокие дозы и длительные антибактериальные курсы, поскольку при этих формах тканевая концентрация препарата обычно ниже, чем при острых.
Препаратом выбора для лечения шейно-лицевой формы актиномикоза является амоксициллин с клавулановой кислотой в дозе 2,4 г 3 раза в день в течение недели, затем 1,2 г 3 раза в день еще 7 дней. Это обычно ведет к полному излечению и очень редко, в хронических случаях, эта форма заболевания нуждается в дополнительной антимикробной терапии.
Такое лечение обычно эффективно и при торакальном актиномикозе, однако в этом случае целесообразно поддерживать дозу 2,4 г 3 раза в день в течение 2 недель и продолжать курс лечения от 3 до 4 недель. Несомненно, что такие высокие дозы (максимальные суточные дозы амоксициллина с клавулановой кислотой составляют 7,2 г) требуют преимущественно парентерального пути введения.
В более тяжелых случаях с целью увеличения тканевой концентрации может потребоваться увеличение дозы аминопеницилинов, что достигается добавлением к терапии ампициллина в дозе до 2 г 3 раза в день.
Во всех случаях абдоминального актиномикоза необходимо предполагать наличие Enterobacteriacae и β-лактамазапродуцирующих Bacteroides spp. Следует помнить, что Enterobacter spp. продуцируют β-лактамазы 1-го типа, не чувствительные ко всем известным ингибиторам β-лактамаз. Поэтому присутствие этих бактерий в очагах поражений является основанием для проведения комбинированной терапии. Подходящие антимикробные комбинации для таких случаев: «амоксициллин с клавулановой кислотой + метронидазол + гентамицин» или «ампициллин + клиндамицин + аминогликозид».
Необходимо упомянуть о том, что в качестве препаратов резерва возможно использование цефалоспоринов 3–го поколения и карбапенемов.
Таким образом, в качестве оптимальных средств эмпирической монотерапии актиномикоза можно рассматривать защищенные аминопенициллины (в частности, амоксициллин с клавулановой кислотой) и карбапенемы, которые обладают наиболее сбалансированным действием на аэробные и анаэробные микроорганизмы, участвующие в развитии микст-инфекции при актиномикозе.
Во всех случаях сроки лечения не должны составлять менее одного месяца, а контроль за эффективностью терапии необходимо осуществлять с использованием компьютерной томографии.
Описание случаев.
Представляем вашему вниманию описание двух случаев актиномикотического поражения кишечника у пациентов, продолжающих наблюдение в микологической клинике СПбМАПО.
Наблюдение 1.: Больная Ш., 42 г, поступила в клинику 12.09.02 г. Впервые умеренные боли в левой половине живота во время menses стала отмечать в феврале 2002 г., расценивала эти боли как проявления аднексита, в связи с чем обращалась к гинекологу по месту жительства. Антибактериальной терапии не получала. С 20.05.02 отмечено повышение температуры до 38,9˚ С, усиление болей в животе. Пациентка обратилась к врачу, при обследовании выявлен лейкоцитоз 17х109/л. Госпитализирована в хирургическое отделение, где была проведена диагностическая лапароскопия, а затем операция: резекция пораженного участка сигмовидной кишки по типу операции Гартмана, удаление большого сальника, аппендэктомия, удаление правых придатков матки, левого яичника. При гистологическом исследовании пораженных участков толстой кишки были выявлены типичные актиномикотические друзы (рис. 1).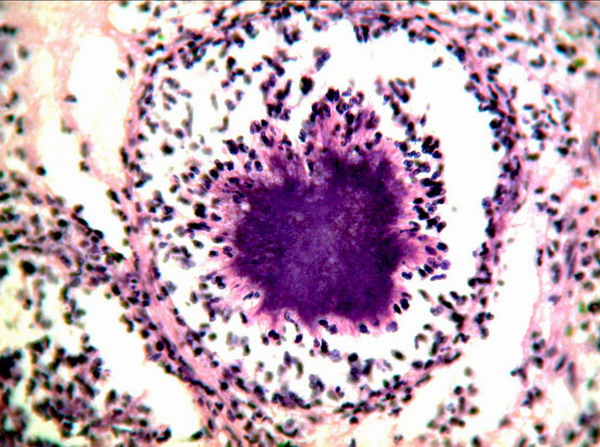
В послеоперационном периоде был извлечен внутриматочный контрацептив. Компьютерная томография брюшной полости и области малого таза не обнаружила очагов инфильтрации, однако была проведен курс противорецидивной терапии «амоксициллин/клавулановая кислота» 375 мг трижды в сутки в течение 4-х недель. При наблюдении в течение 6 мес. признаков рецидива актиномикоза не выявлено.
Наблюдение 2: Больной С., 49лет, жаловался на лихорадку, боли в правой подвздошной области при движении, кашель в течение четырех месяцев. При объективном обследовании в подвздошной области определяли плотный инфильтрат, расцененный как паховая грыжа. Проведенная фиброколоноскопия и рентгеновское исследование кишечника специфической патологии не обнаружили. Была выполнена лапаротомия, выявившая инфильтрат с абсцессом, опорожнявшимся в толстую кишку. Установлен диагноз: «деструктивный аппендицит с аппендикулярным инфильтратом и абсцедированием». При гистологическом исследовании удаленной ткани выявили актиномикотические друзы. В раннем послеоперационном периоде было проведено лечение клафораном внутримышечно по 1 г 2 раза в день, 10 дней. На фоне терапии нормализовалась температура тела, улучшилось общее состояние. Через 4 недели после оперативного лечения при проведении компьютерной томографии патологических образований в брюшной полости выявлено не было, клинические анализы крови в норме. Наблюдение за больным продолжено.
Обсуждение.
Общими чертами обоих наблюдений является отсутствие на начальном этапе развития заболевания выраженной болевой симптоматики и температурной реакции. В обоих случаях наличие инфильтрата побудило врачей предположить наличие опухоли, и диагноз абдоминального актиномикоза был установлен лишь после исследования патологического биоматериала, полученного интраоперационо.
Как показывает первый случай, следует предполагать наличие актиномикоза при обнаружении объемных процессов в малом тазу женщин, имеющих внутриматочный контрацептив. Во втором наблюдении развитие актиномикоза было связано с наличием аппендицита. Достаточно показателен выраженный положительный эффект от курса антибактериальной терапии цефалоспорином III–го поколения, к которому актиномицеты хорошо чувствительны.
Возможность актиномикоза должна быть рассмотрена во всех случаях обнаружения неясных инфильтратов в брюшной полости, особенно при наличии ВМК, и рассматриваться в дифференциальной диагностике опухолеподобных образований.
Наличие микст-бактериальной инфекции полезно предполагать во всех случаях абдоминального актиномикоза. Длительность антибактериальной терапии индивидуальна и зависит от конкретной ситуации, но обычно должна быть не меньше 1 месяца. Даже если проведена радикальная операция по иссечению актиномикотических абсцессов, во всех случаях в послеоперационном периоде должна проводиться противорецидивная терапия.
Случаи абдоминального актиномикоза относительно редки. Поэтому результаты лечения актиномикоза не обсуждены пока в рамках большого контролируемого исследования, и не входят в сферу «доказательной медицины». Сравнительная эффективность различных схем лечения актиномикоза исследована недостаточно. Каких-либо контролируемых исследований результатов лечения произведено не было. Хотя роль микробных ассоциаций при актиномикозе и влияние ее на выбор препаратов еще не вполне ясна, использование лечебных режимов, которые закрывают весь спектр присутствующих бактерий, в течение первоначального курса терапии представляется вполне обоснованным и признается ведущими экспертами по этому вопросу [9]. Авторы будут признательны коллегам за сообщения об опыте применения современных антибактериальных средств при актиномикозе.
Актиномикоз тазовых органов. Необходимо ли длительное лечение антибиотиками?
Pelvic actinomycosis. Is long-term antibiotic therapy necessary?
Department of Obstetrics and Gynecology, Carmel Medical Center, Haifa, Israel.
цель исследования: Описать 11 случаев актиномикоза и проанализировать, необходима ли длительная антибиотикотерапия.
Дизайн исследования: Проведен анализ 11 случаев актиномикоза тазовых органов, диагностированных и пролеченных в течение последних девяти лет. Четыре пациентки имели внутриматочные контрацептивы (ВМК) в течение 6-20 лет, три – имели ВМК в течение 3-5 лет и у четырех этиология была не установлена. У большинства пациенток симптомы заболевания отмечались от нескольких дней до одного месяца. Актиномикотические поражения во всех 11 случаях включали один или оба яичника. У 5 пациенток поражение распространялось и на другие области, такие как матка, сальник, параметриум, тазовая стенка, толстая кишка, мочевой пузырь, слепой мешок и желчный пузырь.
Результаты: Всем больным было проведено оперативное лечение, которое включало удаление очагов с односторонним или двухсторонним удалением придатков и, в отдельных случаях, – при распространенных поражениях – гистерэктомию, оментэктомию, гемиколэктомию и холецистэктомию. Диагноз актиномикоза во всех случаях был подтвержден гистологически, и терапию антибиотиками обычно начинали через 1-14 дней после операции. Препаратом выбора был пенициллин. Длительность лечения составила 12 месяцев у 6 пациенток, 6 месяцев – у 3, и 3 месяца или менее – у двух. Все пациентки выжили и оставались здоровыми в течение 2-9 лет при последующем наблюдении.
Заключение: В отличие от актиномикоза других локализаций, при которых литературные источники рекомендует проводить антибиотикотерапию в течение 6-12 месяцев, при тазовом актиномикозе в случаях, когда абсцессы были полностью удалены хирургическим путем, может быть эффективен и более короткий курс лечения антибиотиками.
АКТИНОМИКОЗ ПОЛОВЫХ ОРГАНОВ У ЖЕНЩИН:
Эпидемиология, этиология, патогенез
(ОБЗОР ЛИТЕРАТУРЫ)
А.К.Мирзабалаева
НИИ медицинской микологии им.П.Н.Кашкина Санкт-Петербургской медицинской академии последипломного образования, Россия
Представленный обзор литературы посвящен эпидемиологии, этиологии и патогенезу актиномикоза гениталий у женщин. Рассмотрены некоторые аспекты патогенеза актиномикотического процесса. Подчеркнута особая роль длительной внутриматочной контрацепции в развитии данного заболевания.
Actinomycosis in the female genital tract:
epidemiology, etiology, pathogenesis
(review)
A.K.Mirzabalaeva
Kashkin Research Institute of Medical Mycology, Saint Petersburg Medical Academy of Postgraduate Education, Russia
The present review is devoted to epidemiology, etiology, pathogenesis of female genital actinomycosis. Some aspects of actinomycosis pathogenesis are considered. The special role of prolonged intrauterine device in developing of this disease is emphasized.
Key words: actinomyces, actinomycosis, intrauterine device, pathogenesis
Актуальность проблемы. По данным из научной литературы, воспалительные процессы внутренних половых органов составляют 62,5% в структуре гинекологической заболеваемости, причем у 9,5% женщин диагностируют гнойные воспалительные заболевания маточных труб и яичников [1]. Частота гнойных воспалительных заболеваний придатков матки ежегодно составляет до 5% от общего числа воспалительных заболеваний половых органов у женщин; пик заболеваемости (54,3%) приходится на период от 31 до 40 лет [2,3]. Наряду с этим отмечена относительно высокая частота гнойных процессов (10,5%) и в более старшей возрастной группе — от 45 лет до 61 года, в том числе у 6,5% женщин в постменопаузальном периоде. Социально-демографические аспекты (семейный статус, возраст больных) в какой-то мере являются индикаторами полового поведения женщины, что оказывает влияние на риск возникновения воспалительных заболеваний гениталий [3-5]. Гнойная инфекция занимает особое место среди воспалительных заболеваний женских половых органов, характеризуется длительным, прогрессирующим течением, склонностью к рецидивам, высокой частотой полиорганных осложнений, нередко являющихся основной причиной инвалидизации и гибели женщин [2].
Особое место в структуре хронических воспалительных гинекологических заболеваний матки, придатков занимает актиномикоз. Актиномикоз органов малого таза у женщин также характеризуется длительным прогрессирующим течением, приводящим к полиорганным осложнениям. Относительно редкое выявление актиномикоза органов малого таза и брюшной полости (8% от общего числа женщин с воспалительными заболеваниями внутренних гениталий) объясняется особенностями клинической картины заболевания, имитирующей неспецифический воспалительный процесс, туберкулез гениталий и новообразования органов женской половой сферы [6-8]. Гнойная инфекция, и актиномикоз в частности, требуют в ряде случаев многокурсовой антибактериальной терапии, повторных оперативных вмешательств, что приводит к длительной нетрудоспособности и значительным экономическим затратам.
Эпидемиология. Актиномикоз - бактериальное заболевание острого, подострого и хронического течения, вызываемое микроаэрофильными бактериями из семейства Actinomycetaceae, встречается повсеместно; актиномикотический процесс может развиваться практически во всех тканях и органах (кожа, подкожная клетчатка, мышцы, органы грудной и брюшной полости, мозговая и костная ткань) [9-12]. Актиномицеты являются условно-патогенными микроорганизмами, и в составе нормобиоты присутствуют на слизистых оболочках полости рта, в слепой кишке и в червеобразном отростке. Больных с такой патологией лечат обычно врачи-микологи.
В настоящее время гнойные воспалительные заболевания придатков матки относят к смешанным полимикробным инфекциям, важнейшими возбудителями которых, по данным Всемирной организации здравоохранения, являются анаэробно-аэробные микроорганизмы (42,5%), Neiseria gonorrhoeae (37,5%), Chlamydia trachomatis (27,5%), Mycoplasma hominis (до 15%) и др. В последние годы именно анаэробной инфекции уделяют особое внимание, поскольку она приобретает реальную значимость в клинической практике. Большинство анаэробов — сапротрофы, постоянно вегетирующие в нижних отделах половых путей и перианальной области. Однако при определенных обстоятельствах и состояниях, способствующих развитию инфекции (сахарный диабет, ожирение, пожилой возраст и др.), бактерии могут мигрировать во внутренние половые органы, вызывая воспалительный процесс. При гнойных воспалительных заболеваниях придатков матки наиболее часто (82,5%) выделяют облигатные анаэробные микроорганизмы [1,8,13,14].
Следует подчеркнуть, что при актиномикозе, как и при большинстве других инфекционных заболеваний, имеет значение не только возбудитель, но и его взаимоотношения с другими микробами, присутствующими в организме человека или попадающими в него извне. Существенную роль в распространении и течении актиномикотического процесса играет неспецифическая микробиота. Пиогенные микроорганизмы, выделяя гиалуронидазу и расплавляя соединительную ткань, могут способствовать “безудержному” распространению процесса по клетчатке. В ряде случаев под влиянием неспецифической микробиоты могут изменяться свойства актиномицетов, что затрудняет диагностику и лечение заболевания. Учитывая существенное влияние неспецифических микроорганизмов на клиническое течение актиномикоза, некоторые авторы различают две стадии заболевания: в первой ведущую роль отводят пиогенным микроорганизмам, во второй — актиномицетам. Целесообразно более подробно рассмотреть среду обитания, морфотинкториальные и бактериологические свойства актиномицетов – возбудителей актиномикотического процесса [10,15-18].
Актиномицеты встречаются повсеместно в огромном количестве в почве, благодаря их способности легко приспосабливаться и довольствоваться органическими соединениями, которые непригодны для других микроорганизмов. На качественный и количественный их состав большое влияние оказывают тип почвы, ее химические и физические свойства, окультуренность, влагоемкость и другие качества [10,11].
К представителям семейства Actinomycetaceae относят собственно актиномицеты рода Actinomyces, проактиномицеты - Proactinomyces (Nocardia) и микобактерии – Mycobacterium. Представители рода Actinomyces имеют хорошо развитый тонкий (0,5-2 мкм), несептированный, разветвленный мицелий, размножаются спорами, образущимися на концах спороносных нитей, или спороносцев. Споры могут образовываться по одной на гифе, парами или цепочками из разного числа клеток в виде мутовок. При достаточном количестве спор цепочки могут быть прямыми, в виде петли или спиральными [9,11,19].
Этиология. В настоящее время семейство Actinomycetaceae объединяет роды Actinomyces, Arachnia, Bifidobacteriиm, Mycobacteriиm, Dermatophilus, Nocardia, Streptomyces. По современной классификации актиномицеты относят к царству бактерий, надцарству прокариот. Возбудителей патологических процессов обычно находят среди Actinomyces mycobacterium, Nocardia и Streptomyces. Их клеточная стенка не содержит хитина и целлюлозы. В ее состав входят: диаминопимелиновая кислота, глицин, арабиноза, галактоза. Кроме того, все актиномицеты содержат глюкозамин, мурамовую кислоту, аланин, глутаминовую кислоту, они способны фрагментироваться на бациллярные и кокковые формы. Актиномицеты грампозитивны и чувствительны к антибактериальным препаратам. Среди них известные аэробные виды (A. viscosus, A. naeslundii, A. Odontolyticus (meyeri), Arachnia propionica), факультативные анаэробы, выраженные анаэробы, например патогенный для человека вид – Actinomyces israelii [11,20,21]. Актиномицеты могут расти на бедных средах, они хорошо переносят высушивание и ультрафиолетовое облучение. Патологический материал обычно засевают в свежепрокипяченную тиогликолевую среду (предпочтительно с сывороткой или другими добавками) на агар с экстрактом мозга и сердца или на чашки Петри с кровяным агаром в атмосфере N2+H2+СО2 (80:10:10) с катализаторами. Через 24 часа можно наблюдать микроколонии, а макроколонии - через 7-14 дней. Для бактериологического исследования используют асцитический или сывороточный бульон с добавлением раствора 5% глюкозы, pH=7,2, культуру выращивают при температуре 37 оС. Способности актиномицетов приспосабливаться к воздействию различных физических факторов и развиваться в аэробных/анаэробных условиях, вероятно, in vivo сказывается на длительном, рецидивирующем течении воспалительного процесса [10,11].
Патогенез. Патогенез актиномикоза женских половых органов окончательно не изучен. Имеются данные о том, что для возникновения заболевания необходим ряд факторов, ослабляющих и сенсибилизирующих макроорганизм (нарушение целостности эпителия кожи или слизистых оболочек (входные ворота), что может произойти во время операций, в результате всевозможных травм, перенесенные ранее инфекции, охлаждение и т.д.). В таких случаях возможно проникновение возбудителя заболевания в ткани [10,22,23].
Данные некоторых исследователей подтверждают, что развитию актиномикоза может предшествовать банальный воспалительный процесс, вследствие чего создаются благоприятные условия для активации и внедрения актиномицетов в пораженные ткани [1,16,18,24].
Существуют различные мнения о путях внедрения и распространения актиномицетов в организме. Различают экзогенный и эндогенный пути проникновения инфекции. При актиномикозе женских половых органов (АЖПО), по-видимому, нельзя полностью отрицать экзогенный путь заражения, хотя ему придают меньшее значение. Описаны единичные случаи развития актиномикоза внутренних половых органов в результате экзогенного заражения вследствие ранения наружных половых органов [6-8,25,26]. Решающая роль в патогенезе АЖПО, вероятно, принадлежит эндогенному пути заражения, причем чаще всего источником инфекции является желудочно-кишечный тракт [7,17,27-29]. Особую роль играет слепая кишка, так как она расположена в непосредственной близости от внутренних половых органов, что имеет важное значение в патогенезе различных воспалительных заболеваний половых органов и, в частности, актиномикоза. Возникновение актиномикоза органов брюшной полости в большинстве случаев можно связать с аппендэктомией. По мнению некоторых авторов, АЖПО является чаще всего вторичным поражением, развивающимся в результате перехода процесса из брюшной полости на органы малого таза [5,29,42]. Из данных научной литературы следует, что пути распространения инфекции могут быть различными, но на первое месте ставят контактный и лишь затем - гематогенный и лимфогенный. Не исключена восходящая инфекция из влагалища и с поверхности кожи [2].
Физиологические циклические изменения, происходящие в женском организме на протяжении менструального цикла, могут способствовать распространению актиномикоза. ежемесячная овуляция и связанное с ней нарушение целостности фолликула создают благоприятные условия для внедрения актиномицетов в яичник. Маточные трубы поражаются в дальнейшем при распространении процесса контактным, гематогенным или лимфогенным путем. В брюшной полости развивается спаечный процесс, который препятствует быстрому распространению инфекции. В дальнейшем в спайки вовлекаются внутренние половые органы (маточные трубы, яичники), париетальная брюшина, сальник, тонкая и толстая кишка, образуется плотный конгломерат, достигающий нередко больших размеров. К факторам риска развития актиномикоза органов брюшной полости и малого таза у женщин относят: длительно текущие хронические воспалительные заболевания матки и придатков, осложненные аборты, роды, лечебно-диагностические внутриматочные вмешательства, гистеросальпингографию, вторичные осложнения после аппендектомии, одонтогенные очаги инфекции (кариозные зубы, зубные гранулемы, пародонтоз) [31,32].
Учитывая особую важность проблемы, отдельно следует остановиться на внутриматочной контрацепции (ВМК) как одной из основных причин развития тяжелых форм гнойных воспалительных заболеваний придатков матки. Большинство исследователей считают, что при использовании ВМК повышается риск развития воспалительных заболеваний придатков матки в 4,5 раза [3,33]. В проведенных исследованиях выявлено, что у 21,4% женщин возникновение гнойной инфекции гениталий было непосредственно связано с использованием внутриматочных спиралей, причем у 89,8% из них длительность нахождения ВМК превышала 3,5 года [23].
В современной научной литературе обсуждают два обстоятельства, связанных с повышенным риском инфицирования внутренних половых органов при „ношении" ВМК. Во-первых, это длительность использования ВМК, во-вторых — его тип. Согласно заключению Совета экспертов ВОЗ (1994), риск развития воспалительных заболеваний придатков матки наиболее высок в течение 1-го месяца после введения контрацептива. В дальнейшем этот показатель снижается, однако при непрерывном использовании внутриматочной спирали более 2 лет частота инфекционных осложнений вновь увеличивается. Высокий риск развития воспалительных заболеваний придатков матки при наличии ВМК объясняется комплексом факторов. Так, в момент введения спирали возможен механический перенос патогенных или условно-патогенных микроорганизмов из нижних отделов половой системы в верхние. Не исключено, что распространение бактерий происходит по нитям ВМК, свисающим во влагалище. Контрацептив, находящийся в полости матки, нарушает слущивание эндометрия во время менструации, подавляет фагоцитоз и другие факторы локальной иммунной защиты, способствует появлению микроэрозий и перифокальной воспалительной реакции стромы [31,34]. У 70% женщин через 2 года после введения ВМК, даже при отсутствии клинической симптоматики, определяются гистологические признаки эндометрита, а у 86% оказываются положительными результаты бактериологического исследования мазков с удаленного контрацептива. Среди изолируемых бактерий преобладают кишечная палочка (37,7%), b -гемолитический стрептококк (19%), золотистый стафилококк в сочетании с анаэробными возбудителями (до 30,1%) [32,35].
Cогласно заключению Совета экспертов ВОЗ, наиболее высок риск инфицирования внутренних половых органов при использовании пластмассовых спиралей (петля Липпса), и значительно ниже (приблизительно в 2 — 5 раз) при применении контрацептивов с медью. Присутствие в ВМК меди способствует подавлению факторов, усиливающих рост анаэробных бактерий, включая A.israelii [13,36].
Данные современной отечественной литературы, посвященные актиномикозу генитального тракта у женщин, немногочисленны [4], материалы по актиномикозу органов брюшной полости представлены лишь описанием отдельных клинических наблюдений. Ряд зарубежных авторов указывают на связь актиномикотического процесса с присутствием в полости матки ВМК или пессариев в вагине [12,33,37,38]. В последние десятилетия были предложены различные методы обнаружения актиномицетов в цервикальном канале и вагине [39]. Обычные образцы изучаемого материала (соскоб из цервикального канала, вагины) содержат, кроме анаэробных или микроаэрофильных актиномицетов, и другие анаэробные микроорганизмы. Из-за трудности выделения актиномицетов-патогенов многие ученые полагаются исключительно на результаты микроскопии окрашенных мазков из цервикального канала с последующим использованием метода прямой иммунофлуоресценции. Известно, что A. species являются обычными обитателями полости рта, глотки и кишечника человека. Вопрос о том, являются ли актиномицеты представителями нормальной вагинальной микробиоты, оставался дискуссионным [40,41], но Перссон (Persson E.) и соавторы (1984) констатировали, что A.israelii может быть представителем вагинальной биоты у здоровых женщин [21,42].
Однако, по данным Дибдала (Dybdahl H.) и соавторов (1991) [44], у женщин, не использовавших ВМК, актиномицеты были обнаружены лишь в единичных случаях (у 2 из 17734 женщин).
Большинство публикаций в различных странах мира посвящены изучению актиномикоза у женщин, использующих ВМК. В США в 1982 г. изучено 69925 цервикальных мазков у пациенток, применяющих ВМК. A.israelii был обнаружен у 10,5% женщин, тогда как при отсутствии контрацептива микроорганизм не был обнаружен ни в одном случае. Многоцентровые исследования были проведены в Индии, Швеции, Австралии. Из полученных данных следует, что обнаружение в цервикальных мазках актиномицетов, преимущественно A.israelii с частотой 11,6%, характерно только при наличии в полости матки внутриматочной спирали; Arachnia propionica, A.naeslundii, A.odontolyticus обнаружены не были [24,36,44].
Какие же методы обнаружения A.israelii могут быть применены? Гупта (Gupta P.K.) и соавторы (1978) [45] идентифицировали A.israelii в цервикальных мазках, используя метод иммунофлюоресценции. Они обнаружили патоген у 94,6% женщин, применявших ВМК (у 250 из 266).
Перссон (Persson E., 1985) [37] использовал иммуно-преципитацию с 98%-м выявлением генитального актиномикоза при чувствительности - 83%. Группа ученых провела сравнительное изучение метода прямой иммунофлуоресценции с традиционным культуральным методом; первый из них оказался более информативным [46]. Такие же данные получили Валиченти (Valicenti J.F.) и соавторы (1982) [40]. По мнению авторов, меньшая информативность культурального метода объясняется тем, что актиномицеты являются медленно растущими и достаточно избирательными микроорганизмами, что и обусловливает сложность их выделения в культурах с быстрорастущими анаэробами, что и объясняет превосходство метода прямой иммунофлуоресценции [37,42].
Боннез (Bonnez W.) и соавторы (1985) первыми продемонстрировали связь актиномикотического процесса в малом тазу с обнаружением актиномицетов в цервикальном канале и наличием ВМК [20]. Эти же исследователи изучили частоту обнаружения актиномицетов в зависимости от вида и длительности нахождения ВМК в полости матки. Самый высокий процент выявления актиномицетов в цервикальном канале (36%) обнаружен при наличии немедикаментозной спирали типа петли Липса, и длительности нахождения контрацептива в полости матки 6-7 лет. Багавен и Гупта (Bhagaven B.S., Gupta P.K., 1978) [45,47] констатировали, что присутствие актиномицетов может сопровождаться следующими клиническими проявлениями: вагинальные выделения, тазовые и абдоминальные боли, меннорагии, лихорадка, формирование опухолевидных образований в малом тазу. Клегхорн и Уилкинсон (Cleghorn A.G., Wilkinson R.G., 1989) показали, что при наличии воспалительных заболеваний малого таза у женщин, A.israelii обнаруживался в четыре раза чаще [22,25]. Показано, что у женщин с ВМК и воспалительным процессом в малом тазу актиномицеты в цервикальном канале обнаруживаются в 17-25% случаев [12,23,48]. однако, Пайн (Pine L.) и соавторы (1981) подтверждают, что обнаружение актиномицетов во влагалище при отсутствии клинических симптомов поражения внутренних половых органов имеет малое прогностическое значение, т.к., по мнению этих авторов, так называемые “лучистые грибки” являются нормальными представителями микробиоты влагалища [46].
Таким образом, актиномицеты, присутствующие в цервикальном канале и на слизистой влагалища – сапробионты и являются участниками нормальной микробиоты. Несмотря на то, что представления о патогенезе разноречивы, очевидно, что длительное присутствие ВМК способствует колонизации актиномицетами слизистой оболочки цервикального канала и является одной из наиболее вероятных причин возникновения актиномикоза половых органов у женщин.