Евтушенко С.К., Морозова Т.М., Москаленко М.А., Донецкий национальный медицинский университет им. М. Горького, кафедра детской и общей неврологии ФИПО, Областная детская клиническая больница, г. Донецк
Под термином «синдром пустого турецкого седла» (ПТС) следует понимать пролабирование супраселлярной цистерны в полость турецкого седла [1, 2]. Вход в турецкое седло в норме прикрывает твердая мозговая оболочка, называемая диафрагмой седла. Диафрагма отделяет полость турецкого седла и гипофиз от субарахноидального пространства, исключая лишь отверстие, через которое проходит ножка гипофиза. Прикрепление диафрагмы, ее толщина и характер отверстия могут иметь значительные анатомические вариации. Недостаточность диафрагмы является обязательным условием формирования ПТС [2–4]. Термин «пустое турецкое седло» не следует понимать буквально: оно заполнено ликвором, гипофизарной тканью, иногда в него могут «провисать» хиазма и зрительные нервы [1–4]. Клинические симптомы, ассоциированные с пустым седлом, сопровождаются цефалгией, нейроэндокринными и зрительными расстройствами [1, 2, 4, 5]. Однако, по литературным данным, от 10 до 50 % врожденных дефектов диафрагмы седла могут до определенного времени оставаться клинически бессимптомными [1–3, 6].
Словосочетание «пустое турецкое седло» ввел в медицину W. Busch в 1951 году. Он был первым, кто связал частично пустое турецкое седло с недостаточностью диафрагмы [2, 6].
Различают первичный (вследствие врожденной или приобретенной недостаточности диафрагмы седла) и вторичный синдром ПТС (развивающийся после оперативной или лучевой терапии по поводу опухоли гипофиза) [2]. Установлено, что для формирования ПТС необходимо два условия: недостаточность диафрагмы и внутричерепная гипертензия [1, 2, 4, 7].
Факторы, способствующие развитию пустого турецкого седла:
— наследственная неполноценность соединительной ткани;
— повышение внутричерепного давления (вследствие легочно-сердечной недостаточности, артериальной гипертензии, черепно-мозговой травмы, при опухолях головного мозга, тромбозе синусов);
— спонтанный некроз аденомы гипофиза, инфаркт гипофиза;
— инфекционные заболевания с тяжелым течением (менингит, геморрагическая лихорадка, арахноидальные кисты, развившиеся в результате оптико-хиазмального арахноидита);
— аутоиммунные заболевания (аутоиммунный тиреоидит, болезнь Шегрена, лимфоцитарный аденогипофизит);
— первичная гипофункция периферических эндокринных желез, длительный прием оральных контрацептивов;
— физиологические процессы (беременность, роды, климакс).
Выделяют синдром ПТС без клинических проявлений (симптом ПТС) и синдром ПТС с гипоталамо-гипофизарными и зрительными нарушениями [1, 2, 4, 7]. Уменьшение размеров гипофиза не всегда приводит к снижению его секретирующей способности. Гипопитуитаризм отмечается лишь при повреждении 70–75 %, а пангипопитуитаризм — при повреждении не менее 90 % объема гипофиза [8]. При первичном синдроме пустого турецкого седла функция гипофиза, как правило, не нарушена.
Клиническая картина отличается динамичностью, сменяемостью одного синдрома другим, спонтанными ремиссиями. Чаще болеют женщины [1, 2, 5]. Самым частым симптомом является хроническая головная боль (80–90 %), не имеющая четкой локализации и варьирующая от легкой до нестерпимой. Около 75 % больных страдают ожирением. Дисфункция гипоталамуса выражается вегетативными синдромами и вегетативными кризами с ознобом, резким подъемом артериального давления, кардиалгией, одышкой, чувством страха, болями в животе, в конечностях, повышением температуры. Нередко отмечаются синкопальные состояния. Наряду с вегетативными нарушениями больные с синдромом ПТС подвержены эмоционально-личностным и мотивационным расстройствам. Клиническая симптоматика и течение болезни усугубляются в связи с острой или хронической стрессовой ситуацией [1, 2, 5, 9–11].
Эндокринные симптомы при ПТС обусловлены нарушением тропной функции гипофиза, проявляются в виде гипо- или гиперсекреции и варьируют по степени тяжести от субклинических до тяжелых форм [2, 8, 10, 12]. Наиболее характерные проявления — гипотиреоз, гиперпролактинемия и половые нарушения (снижение потенции, либидо, олиго- и аменорея), болезнь Ищенко — Кушинга, акромегалия [2, 13–15]. Причиной эндокринных расстройств при ПТС принято считать не компрессию секреторных клеток гипофиза, которые продолжают функционировать даже при значительной гипоплазии, а нарушение гипоталамического контроля над гипофизом в результате затруднения поступления нейрогормонов гипоталамуса [1, 2, 4, 15, 16].
Офтальмологическое обследование у пациентов с синдромом ПТС имеет исключительную важность для диагностики заболевания и выбора тактики лечения. Угроза потери зрения является показанием для хирургического вмешательства [6, 18, 19]. Изменения со стороны зрительной системы различны по характеру и степени выраженности [2, 7, 10, 17, 18]. Чаще всего больных беспокоят ретробульбарные боли, сопровождаемые слезотечением, хемозом, диплопией, фотопсиями, затуманиванием зрения. Снижение остроты и изменение полей зрения, отек и гиперемия диска зрительного нерва, выявляемые при обследовании, подвержены колебаниям и зависят от ликворной дистензии и кровоснабжения хиазмально-зрительного пути [10, 19]. Для синдрома ПТС характерны дефекты полей зрения. Сформированы две патогенетические концепции нарушения полей зрения при ПТС: тракционная и ишемическая. Согласно первой к дефектам в полях зрения может привести натяжение между хиазмой и передним краем диафрагмы (при смещении последней в полость турецкого седла), а также натяжение между хиазмой и ножкой гипофиза (при смещении ножки назад и в сторону). В качестве второй рассматриваются сдавление глазничной артерии в субарахноидальном пространстве, окружающем зрительный нерв, и ухудшение кровоснабжения самой хиазмы и зрительного нерва [2, 17]. Чаще встречаются битемпоральные гемианопсии, центральные и парацентральные скотомы, реже — квадрантные и биназальные гемианопсии [2, 9, 17–19].
Чувствительность МРТ в диагностике синдрома ПТС составляет практически 100 % [3, 20, 21]. Для ПТС характерна триада симптомов:
1) наличие цереброспинальной жидкости (ЦСЖ) в полости турецкого седла, о чем свидетельствуют зоны однородного низкоинтенсивного сигнала в режиме T1W и высокоинтенсивного сигнала в режиме T2W, гипофиз при этом деформирован, имеет форму серпа или полулуния толщиной до 2–4 мм, ткань его изоинтенсивна белому веществу мозга, воронка, как правило, расположена центрально;
2) асимметричное пролабирование супраселлярной цистерны в полость седла, смещение воронки кпереди, кзади или латерально;
3) истончение и удлинение воронки гипофиза.
Помимо основных изменений в параселлярной области МРТ позволяет выявить косвенные признаки внутричерепной гипертензии (расширение желудочков и ликворосодержащих пространств), сопутствующей этой патологии.
Лабораторная диагностика основана на определении тропных гормонов гипофиза, однако при синдроме ПТС нет определенности и стабильности в этих показателях [1, 5, 12].
При первичном синдроме ПТС лечение обычно не требуется. Изредка возникает необходимость в заместительной гормональной и симптоматической терапии. Напротив, при вторичном синдроме ПТС заместительная гормональная терапия необходима почти всегда. Очень редко наблюдается истечение из носа ЦСЖ, которая просачивается через истонченное дно турецкого седла, что также служит показанием к хирургическому вмешательству при первичном синдроме пустого турецкого седла.
Наличие эпилептических припадков, легких когнитивных нарушений, признаков мезоэктодермальной дисплазии [11], данные нейрофизиологического, нейроофтальмологического, радиологического и нейровизуализационного исследований способствовали поиску синдромов, связанных с генными мутациями, кодирующими первичный синдром ПТС, а также с патологией других органов и систем, описание которых приведено ниже.
605020 (MIM) Краниофациальные аномалии, включающие пустое турецкое седло, роговичные эндотелиальные изменения и ретинальные и слуховые аномалии биполярных клеток. Ген картирован на 20p11.2 и назван visual system homeobox gene 1 (VSX1). VSX1 выявлен в эмбриональных краниофациальных структурах, эмбриональном и взрослом мозге, сердце, почках, печени, легких, скелетной мускулатуре, селезенке и тимусе [22], во взрослой сетчатке, где ведает распределением красно-зеленого визуального пигмента [23]. Heon и др. (2002) идентифицировали мутацию гена VSX1 в 2 унаследованных человеком дистрофиях роговой оболочки: задней полиморфной дистрофии роговицы (posterior polymorphous corneal dystrophy — PPCD1) и кератоконусе [24]. Однако с любой мутацией VSX1 электроретинографически было обнаружено нарушение функции сетчатки. Mintz-Hittner и др. (2004) нашли G-T трансверсию в кодоне 256 протеина VSX1, что приводит к обмену аланина на серин (A256S) [25]. Клинические данные продемонстрировали чрезвычайно вариабельную экспрессивность, но все индивидуумы имели широкое расстояние между зрачками, анормальный роговичный эндотелий и необычную форму ушных раковин. Другие вариации включали частично или полностью пустое турецкое седло, иногда кисту задней черепной ямки или переднее энцефалоцеле и/или гидроцефалию. Электрофизиологические исследования предоставили свидетельство анормальности биполярных клеток сетчатки (при исследовании зрительных вызванных потенциалов и электроретинограммы) и слуховых биполярных клеток (на аудиограмме и стволовых слуховых вызванных потенциалах) при проспективных исследованиях у взрослых.
612913 (MIM) Орофациодигитальный синдром (orofaciodigital syndrome XI; OFDS XI); синдром Габриэлли. Спонтанная мутация, единичные случаи.
Gabrielli и др. (1994) сообщили о новом OFD синдроме, ассоциированном со скелетными и черепно-лицевыми аномалиями, с выраженной психомоторной задержкой [26]. КT-сканирование черепа показало дупликацию vomer, расщепление решетчатой кости, неполного апофиза crista galli , дегисценцию этмоидальной пластины и расщепление неба, гипоплазированные и деформированные зубные отростки. Наблюдалось также незаращение задней дуги C2 и C3, частичный синостоз между атлантом и затылочной костью и расщепление тел шейных позвонков. Ferrero и др. (2002) описали девочку с синдромом OFD, ассоциированным с носоглоточным полипом, частичным синостозом между атлантом и затылочной костью, множественными проксимально-цервикальными и дистально-грудными расщеплениями позвонков, кифосколиозом, пустым турецким седлом и когнитивными нарушениями [27].
182230 Септооптическая дисплазия. Синдром De Morsier. Septooptic dysplasia (SOD); ген картирован 3p21.2-p21.1; мутация HESX1. Септооптическая дисплазия — клинически гетерогенное заболевание, которое определяется любой комбинацией гипоплазии зрительного нерва, гипоплазии гипофиза и аномалией мозга по средней линии, включая отсутствие мозолистого тела и прозрачной перегородки [28]. Описаны формы с кардиомиопатией. Willnow и др. (1996) сообщили данные изучения 18 больных c SOD. CКT или MРT показали следующие результаты: 4 пациента имели дефект прозрачной перегородки, 3 — гипоплазию мозжечка, 1 — аплазию мозолистого тела и 1 — аплазию серпа. Пустое турецкое седло без смещения или со смещением гипофиза наблюдалось в 4 случаях. Тяжелая психомоторная задержка присутствовала у 14 из 18 пациентов. Все пациенты имели низкий рост. Окружность головы и вес соответствовали норме. Была выявлена высокая распространенность гипофизарной дисфункции, обычно с дефицитом соматотропного и тиреотропного гормонов [29].
222448 Фациоокулоакустикоренальный синдром. Donnai-Barrow syndrome/faciooculoacousticorenal syndrome (DBS/FOAR синдром). Аутосомно-рецессивный. Ген картирован 2q24-q31, мутация в LRP2.
Проявления клинической картины полиморфны [30]: макроцефалия, увеличен большой родничок, расширение метопического шва, гипоплазия лицевого черепа. Низкорасположенные и ротированные кзади ушные раковины, сенсоневральная тугоухость. Короткий, распластанный нос. Со стороны органа зрения: гипертелоризм, высокая миопия, колобома и гипоплазия радужной оболочки, катаракта, дауноподобный разрез глаз, надорбитальные складки кожи, ретинальная дистрофия, экзофтальм. Кардиоваскулярные дефекты: часто септальный вентрикулярный дефект, редко удвоение восходящей части vena cava . Респираторные аномалии: пульмональная гипоплазия, вторичная диафрагмальная грыжа, диафрагмальная эвентрация. Гастроинтестинальные признаки: кишечная мальротация, пупочная грыжа, омфалоцеле. Гениторенальные нарушения: двурогая матка, проксимальная неацидотическая тубулопатия. ЦНС: парциальная или полная агенезия мозолистого тела, пустое турецкое седло, умственная отсталость. Лабораторные данные: протеинурия, выделение с мочой ретинол-связанных и витамин-D-связанных протеинов.
Молекулярная основа [31]: мутация в гене липопротеина низкой плотности к рецептор-зависимому протеину 2 (LRP2).
130720 Пустого турецкого седла первичный синдром. Lateral meningocele syndrome, Lehman syndrome. Клинически: дефект спинки турецкого седла, увеличение размеров турецкого седла, внутреннего слухового прохода и отверстия зрительного нерва, добавочные косточки в лямбдовидном шве, остеосклероз, приподнятые углы нижней челюсти, аномалии развития спинного мозга, мозжечка и коры, множественные спинномозговые грыжи, умеренная задержка роста, гипоплазия лица, антимонголоидный разрез глаз, гипоплазия десен, высокое арковидное небо, гипоплазия нижней челюсти, увеличенное большое затылочное отверстие, платибазия, базилярная импрессия, расширение спинномозгового канала и внутрипозвонковых отверстий, аномалии тел позвонков [32–34].
Мы представляем клинический случай с синдромом ПТС у ребенка.
Девочка А., 10 лет, поступила в неврологическое отделение с жалобами на миоклонические подергивания плечевого пояса и рук, судорожные припадки с нарушением сознания. Периодически беспокоили головные боли, снижения зрения в сумерках.
Анамнез болезни. Ребенок болен в течение месяца, когда появились единичные миоклонические судороги в верхнем плечевом поясе. Затем они участились до нескольких раз в день, стали серийными. Дважды развивались генерализованные судорожные припадки.
Анамнез жизни. Девочка от I беременности, срочных родов. Масса при рождении — 3200 г . Обвитие пуповины вокруг шеи. Оценка по шкале Апгар — 8 баллов. В развитии не отставала.
В неврологическом статусе: короткая шея. Необычная форма и уменьшение размеров ушных раковин. Гипертелоризм. Глазные щели S > D, зрачки D = S. Задний межъядерный офтальмопарез. Сглажена левая носогубная складка. Сухожильные рефлексы равномерно оживлены. Статика и координация не нарушены. Гипермобильный суставной синдром. Нарушение осанки, поясничный гиперлордоз. Плоскостопие.
Электрокардиоскопия: полувертикальная электрическая позиция сердца.
Электроэнцефалография: при пробуждении и гипервентиляции — короткие разряды генерализованных билатерально-синхронных комплексов пик — волна без видимых клинических проявлений. Фотосенситивность не выявлена. Паттерн соответствует одной из форм идиопатической генерализованной эпилепсии.
Осмотр окулиста: VOU = 0,9. Глазное дно в норме. Незначительное сужение битемпоральных полей зрения.
Зрительные вызванные потенциалы на предъявление хроматического и ахроматического реверсивного шахматного паттерна (ШП) показали межполушарную асимметрию и удлинение латентности N75, P100, N145 (табл. 1–3).
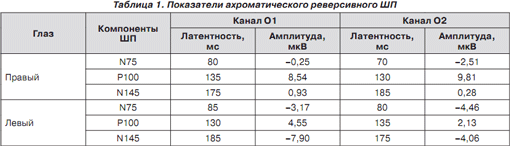
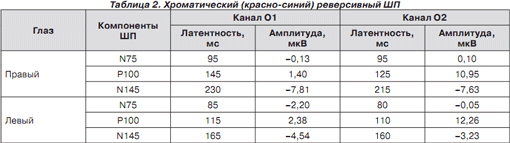
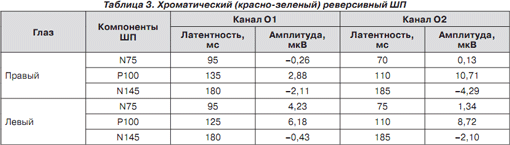
Изменения показателей латентности были также обнаружены при предъявлении красно-синего и красно-зеленого хроматического ШП, что подтверждает нарушение зрения на цвета (табл. 2–3).
Исследование реверсивного ШП по квадрантам зрения показало удлинение латентности P100 от темпоральных и нижнего назального квадрантов левого глаза и нижнего темпорального квадранта правого глаза (рис. 1).

Зрительные когнитивные вызванные потенциалы (КВП): удлинение латентности P300, N400 при исследовании абстрактно-вербального паттерна, снижение амплитуды. Удлинение времени сенсомоторной реакции (табл. 4).
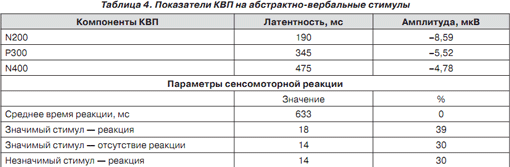
Слуховые КВП соответствуют возрастным нормам.
Психологическое тестирование. MMSE: 26 баллов; FAB: 13 баллов; тест рисования часов: 8 баллов; тест запоминания 10 слов: максимально 7 слов, неустойчивое внимание, лишние слова; таблицы Шульте: эффективность работы 50 с — 4 балла, психическая устойчивость — 1 балл.
Выводы: легкие когнитивные расстройства. Лобная дисфункция с нарушением семантической памяти, концептуализации, беглости речи, динамического праксиса. Снижение концентрации внимания. Недостаточная психическая устойчивость.
Ультразвуковая допплерография сосудов шеи и головного мозга: церебральный артериальный кровоток без патологии. Умеренно ускорен кровоток по экстракраниальным сегментам ВСА, S > D. Признаки дистонии церебральных артерий и яремных вен. Затруднение венозного оттока из передних отделов черепа, S > D.
Рентгенография черепа: турецкое седло глубокое, контуры четкие, порозность спинки. Индекс турецкого седла — 0,85 (норма — 0,84–1,0).
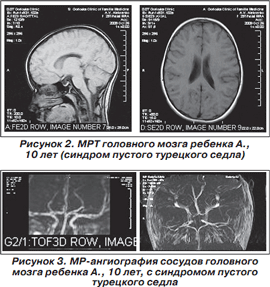
МРТ головного мозга: гипофиз уменьшен в объеме, однородный, распластан по дну турецкого седла. Дополнительных образований и очагов патологического МР-сигнала в нем не определяется. Супраселлярные цистерны выполняют полость турецкого седла. Тела боковых желудочков расширены до 1,3 см (рис. 2).
МРА: S-образная извитость левой ВСА (рис. 3).
В крови: билирубин — 9,8 мкмоль/л (непрямой — 9,8, прямой — 0), АЛТ — 33 Ед/л, АСТ — 16 Ед/л, глюкоза крови — 4,5 ммоль/л.
Пролактин крови — 129,5 мкМЕ/мл (норма от 127 до 637 мкМЕ/мл), ФСГ — 4,12 мМЕ/мл (норма от 0,2 до 3,8 мМЕ/мл), лютеинизирующий гормон — 0,138 мМЕ/мл (норма от 0 до 0,2 мМЕ/мл), тиреотропный гормон — 2,46 мкМЕ/мл (норма от 0,28 до 4,30 мкМЕ/мл).
Осмотр эндокринолога патологии не выявил.
Проведена терапия: конвулекс ретард, диакарб, аспаркам. Приступы купировались.
Таким образом, учитывая краниофациальные и аурикулярные стигмы, аномалию цветового восприятия, когнитивные нарушения, эпилептические припадки, наличие первичного синдрома ПТС, мы высказали предположение о дефекте VSX1, картированного на 20p11.2: (605020 MIM) Краниофациальные аномалии, включающие пустое турецкое седло, роговичные эндотелиальные изменения и ретинальные и слуховые аномалии биполярных клеток. Однако отсутствие возможности детекции гена в наших условиях повлекло следующую формулировку диагноза: симптоматическая эпилепсия с частыми миоклоническими и генерализованными судорожными приступами. Врожденный синдром пустого турецкого седла. Врожденная дисплазия соединительной ткани с гипермобильным суставным синдромом, извитостью левой внутренней сонной артерии.

Под термином синдром «пустого» турецкого седла (ПТС) следует понимать пролабирование супраселлярной цистерны в полость турецкого седла, сопровождающееся клинической картиной головной боли, нейроэндокринных и зрительных расстройств.
Единство нейрогуморальной регуляции в организме человека обеспечивается гипоталамо–гипофизарой системой, в тесной анатомической связи с которой находятся зрительные нервы и хиазма. Развитие конфликта в хиазмально–гипоталамо–гипофизарной области приводит к нарушениям зрения [21,36].
Словосочетание «пустое» турецкое седло ввел в медицину W. Busch в 1951 году. Он был первым, кто связал частично «пустое» турецкое седло с недостаточностью диафрагмы, и им же была предложена классификация форм турецкого седла в зависимости от объема интраселлярных цистерн и типа строения диафрагмы [11,20,22,25].
По данным Busch, у 40–50% людей имеет место недоразвитие или отсутствие диафрагмы турецкого седла. Клинические симптомы, ассоциированные с «пустым» седлом, впервые описал в 1968 г. N Guiot [36]. Встречаются они значительно реже (по данным различных авторов, от 10 до 23% от группы нейроэндокринных больных) [3, 19].
Weiss и Raskin указали на необходимость разграничения первичного (идиопатического) ПТС и вторичного (после лучевого и хирургического лечения) [20,21,22].
Анатомия турецкого седла
Вход в турецкое седло прикрывает твердая мозговая оболочка, называемая диафрагмой седла (рис. 1). Диафрагма отделяет полость турецкого седла и гипофиз от субарахноидального пространства, исключая лишь отверстие, через которое проходит ножка (воронка) гипофиза. Прикрепление диафрагмы, ее толщина и характер отверстия подвержены значительным анатомическим вариациям [6,20,22, 23,37]. Диафрагма может быть недоразвитой, с резко увеличенным отверстием, через которое в полость седла в разной степени внедряется супраселлярная цистерна [3,7,12,20,38,41]. «Пустое» турецкое седло не следует понимать буквально: оно заполнено ликвором, гипофизарной тканью, иногда в него могут «провисать» хиазма и зрительные нервы [6,41].
Рис 1. Схема строения турецкого седла [41]
В 80% случаев встречается переднее пролабирование супраселлярной цистерны [7,41] (рис. 2).
Рис 2. Пролабирование супраселлярной цистерны в полость турецкого седла (ПТС) [41]
Этиология и патогенез ПТС
Паутинная оболочка пролабирует в полость турецкого седла через отверстие в диафрагме в том случае, если размер последнего превышает 5 мм [22,25,34,41]. Недостаточность диафрагмы является обязательным условием формирования ПТС.
В настоящее время известен широкий спектр патологических и физиологических факторов, способствующих развитию «пустого» турецкого седла:
– повышение внутричерепного давления вследствие легочно–сердечной недостаточности, артериальной гипертензии, черепно–мозговой травмы;
– локальное повышение давления в желудочках при опухолях головного мозга, тромбозе синусов;
– физиологические процессы (беременность, роды, климакс);
– первичная гипофункция периферических эндокринных желез, длительный прием оральных контрацептивов;
– арахноидальные кисты, развившиеся в результате оптико–хиазмального арахноидита;
– спонтанный некроз аденомы гипофиза, инфаркт гипофиза;
– инфекционные заболевания с тяжелым течением (менингит, геморрагическая лихорадка);
– аутоиммунные заболевания (аутоиммунный тиреоидит, болезнь Шегрена, лимфоцитарный аденогипофизит);
– наследственная неполноценность соединительной ткани (наличие ПТС у родителей и детей).
Таким образом, установлено, что для формирования «пустого» турецкого седла необходимо два условия: недостаточность диафрагмы и внутричерепная гипертензия, остальные факторы лишь способствуют его развитию [1,20,22,29,34].
Клиника синдрома ПТС
Клиническая картина отличается динамичностью, сменяемостью одного синдрома другим, спонтанными ремиссиями [2,3,22,].
Чаще болеют женщины (4/5) в возрасте от 35 до 55 лет. Около 75% больных страдают ожирением [13,22,29,36].
Самым частым симптомом является головная боль (80–90%), не имеющая четкой локализации и варьирующая от легкой до нестерпимой, почти постоянной [2,13,8,22,26]. Дисфункция гипоталамуса выражается вегетативными синдромами и вегетативными кризами с ознобом, резким подъемом артериального давления, кардиалгиями, одышкой, чувством страха, болями в животе, в конечностях, подъемом температуры, нередко синкопальными состояниями [2,8,22,32]. Наряду с вегетативными нарушениями больные с синдромом ПТС подвержены эмоционально–личностным и мотивационным расстройствам. Клиническая симптоматика и течение болезни усугубляются в связи с острой или хронической стрессовой ситуацией [3,5].
Эндокринные симптомы при ПТС обусловлены нарушением тропной функции гипофиза, проявляются в виде гипо– или гиперсекреции и варьируют по степени тяжести: от субклинических форм до тяжелых. [1,12,13, 20,22, 24,33]. Per Bjerre отмечает, что гипофизарные нарушения при синдроме ПТС аналогичны изменениям при аденоме гипофиза и часто имеет место сочетание ПТС с микроаденомами [22]. Гипотиреоз, гиперпролактинемия и половые нарушения (снижении потенции, либидо, олиго– и аменорея) наиболее характерны для больных этой группы [21,31,37]. Brismar обнаружил ПТС у больных с болезнью Иценко–Кушинга, Dominique сообщил о наличии ПТС у 10% больных акромегалией [7,13,22,37].
Причиной эндокринных расстройств при ПТС принято считать не компрессию секреторных клеток гипофиза, которые продолжают функционировать даже при значительной гипоплазии, а нарушение гипоталамического контроля над гипофизом в результате затруднения поступления нейрогормонов гипоталамуса [3,6,29,35,36,39].
Зрительные нарушения при синдроме ПТС
Изменения со стороны зрительной системы различны по характеру и степени выраженности [1,5,8,19,20,22,32]. Чаще всего больных беспокоят ретробульбарные боли, сопровождаемые слезотечением, хемозом, диплопией, фотопсиями, «затуманиванием» [32,38].
Снижение остроты зрения, изменения полей зрения, отек и гиперемия диска зрительного нерва (ДЗН), выявляемые при обследовании, подвержены колебаниям и зависят от ликвороциркуляции в арахноидальных пространствах и кровоснабжения хиазмально–зрительного пути [5,8,38].
По данным Obrador S., из 19 пациентов с синдромом ПТС у 7 зрительные расстройства выражались только субъективными симптомами (неясное зрение, диплопии, фотопсии), у 3 офтальмоскопически определялся двусторонний отек ДЗН, у 2 при периметрии выявлены гемианопсии без очевидной причины. 7 пациентов с ПТС не имели зрительных нарушений [38].
Для синдрома ПТС характерны дефекты полей зрения. Чаще встречаются битемпоральные гемианопсии, центральные и парацентральные скотомы, реже – квадрантные и биназальные гемианопсии [1,19,20,27,29,36].
Bosman and Bergstrand обнаружили дефекты полей зрения у 10 из 48 пациентов с ПТС, Jaja–Albarran у 6 из 41, Per Bjerre у 3 из 20, Mortara and Non–ell у 4 из 7 [22,24,33].
Сформированы две патогенетические концепции нарушения полей зрения при ПТС: тракционная и ишемическая. Согласно первой концепции, к дефектам в полях зрения может привести натяжение между хиазмой и передним краем диафрагмы (при смещении последней в полость турецкого седла) а также натяжение между хиазмой и ножкой гипофиза (при смещении ножки назад и в сторону). В качестве второй – ишемической–теории рассматриваются варианты сдавления глазничной артерии в субарахноидальном пространстве, окружающем зрительный нерв, и ухудшения кровоснабжения самой хиазмы и зрительного нерва при удалении их от каротидного бассейна [27,29,36].
Биназальные и квадрантные гемианопсии подобны изменениям полей зрения при первичной открытоугольной глаукоме. Дифференциальная диагностика в этих случаях трудна, но имеет важное значение, т.к. глаукома с низким давлением не является редкостью и требует особого внимания офтальмолога [1,20,40,43]. Имеются данные о нередком сочетании ПТС с глаукомой.
Beattie у 8 пациентов с глаукомой обнаружила синдром ПТС: 3 имели глаукому с низким давлением, 4– типичную открытоугольную глаукому и 1– неоваскулярную глаукому. Глаукоматозная экскавация ДЗН была выявлена стереоскопической дискоскопией и подтверждена стереофотографией. Больные в течение 5 лет получали местную гипотензивную терапию с положительным эффектом: глаукома имела стабильное течение без прогрессирования дефектов полей зрения [20].
Существует иная точка зрения на эту проблему. Berke, Neelon, Yamayashi также описывают случаи глаукомы с низким давлением в сочетании с ПТС и высказывают предположение о наличии у этих больных «псевдоглаукомы» [20,37,43]. Однако Rouhiainen, исследуя 15 пациентов с глаукомой низкого давления, имеющих синдром ПТС, пришел к выводу, что все же более правильным следует считать совпадение синдрома ПТС с глаукомой [40].
Вегетативные кризы, характерные для синдрома ПТС, усугубляют ситуацию и могут привести к нарушению кровообращения в центральной артерии сетчатки (ЦАС). Как правило, эти нарушения встречаются у молодых женщин, страдающих ожирением и эндокринными расстройствами [19,29].
Синдром ПТС выявляется у 10% больных с доброкачественной внутричерепной гипертензией (ДВГ), главными клиническими симптомами которой также являются головная боль и отек зрительного нерва [5,8,22,23]. Причина ДВГ остается неясной. Наиболее частым этиологическим фактором считают эндокринные нарушения: ожирение, гипо– и гипертиреоз, галакторея–аменорея, беременность, климакс. Per Bjerre сообщает о случаях внезапной потери зрения у пациентов с ДВГ, причиной которой является усиление отека зрительных нервов и сдавление их в оптическом канале [22,23]. Взаимосвязь ПТС и доброкачественной внутричерепной гипертензии, вероятно, бывает двоякой [22].
Офтальмологическое обследование у пациентов с синдромом ПТС имеет исключительную важность для диагностики заболевания и выбора тактики лечения. Угроза потери зрения является показанием для хирургического вмешательства [3 6].
Инструментальная диагностика ПТС
До последнего времени в диагностике «пустого» турецкого седла использовались лучевые методы исследования: краниография, пневмоцистернография и компьютерная томография, которые были недостаточно информативны и безопасны [22,24,33].
Безопасным и высокочувствительным методом визуализации хиазмально–селлярной области в настоящее время является магнитно–резонансная томография (МРТ) [6,38,41].
МРТ позволяет проводить исследования в любой плоскости тонкими срезами в 1–1,5 мм, обладает высоким тканевым контрастом, отсутствием артефактов от костных структур черепа.
Для ПТС характерна триада симптомов:
· первый симптом – наличие цереброспинальной жидкости в полости турецкого седла, о чем свидетельствуют зоны однородного низкоинтенсивного сигнала в режиме T1W и высокоинтенсивного сигнала в режиме T2W, гипофиз при этом деформирован, имеет форму серпа или полулуния толщиной до 2–4 мм, ткань его изоинтенсивна белому веществу мозга, воронка, как правило, расположена центрально;
· второй – асимметричное пролабирование супраселлярной цистерны в полость седла, смещении воронки кпереди, кзади или латерально;
· третий – истончение и удлинение воронки гипофиза.
Помимо основных изменений в параселлярной области МРТ позволяет выявить косвенные признаки внутричерепной гипертензии (расширение желудочков и ликворосодержащих пространств), сопутствующие этой патологии.
Имеются данные о почти 100% чувствительности МРТ в диагностике синдрома ПТС [7,10,38,41].
Лабораторная диагностика
Основана на определении тропных гормонов гипофиза, но нет определенности и стабильности в этих показателях, что также характерно для ПТС [1,13,20,33].
Таким образом, синдром ПТС представляет собой симптомокомплекс нейроэндокринных и зрительных расстройств, по клинической картине схожий с аденомой гипофиза. Этиологию и патогенез синдрома определяют врожденная недостаточность диафрагмы, повышенное внутричерепное давление и ряд сопутствующих факторов. Причиной нейроэндокринных расстройств принято считать не компрессию секреторных клеток гипофиза, а сдавление его ножки, что приводит к нарушению гипоталамического контроля над гипофизом.
Зрительные расстройства представлены субъективными жалобами, дефектами в полях зрения и ухудшением остроты зрения, обусловлены они как повышенным давлением в субарахноидальном пространстве, окружающем зрительный нерв, так и ишемией хиазмально–зрительной системы. Офтальмоскопические изменения при синдроме ПТС выражаются гиперемией и отеком зрительного нерва, но могут быть представлены атрофией ДЗН с типичной глаукоматозной экскавацией. Отмечено сочетание синдрома ПТС с глаукомой.
Клиническое течение синдрома рецидивирующее, обусловлено степенью эндокринных, неврологических и зрительных нарушений. Как правило, болезнь протекает благоприятно при ранней диагностике и адекватной симптоматической терапии. Тяжелые прогрессирующие зрительные нарушения являются показаниями для хирургического лечения.