Клиническая и патологическая классификации первичной опухоли (T) идентичны. Если измерения выполнены при физикальном осмотре, то клиницист может использовать параметры T1, T2 или T3. Если измерение опухоли выполнялось при маммографии или при микроскопическом исследовании препарата, то могут быть использованы параметры Т1а, Т1b и т.д. Размер шага при измерении опухоли не должен превышать 0,1 см.
Первичная опухоль (T)
- TX: Первичная опухоль не может быть измерена.
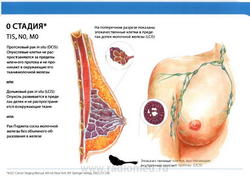
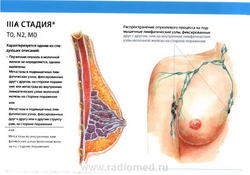
- T0: Признаки первичной опухоли отсутствуют.
- Tis: внутрипротоковая карцинома in situ, дольковая карцинома in situ или болезнь Педжета соска без признаков инвазии в нормальные ткани молочной железы
- Tis (DCIS): протоковая карцинома in situ;
- Tis (LCIS): дольковая карцинома in situ;
- Tis (Педжета): болезнь Педжета с поражением только соска без наличия измеряемой опухоли.
Замечание: болезнь Педжета при наличии измеряемой опухоли классифицируется в соответствии с размерами опухоли.
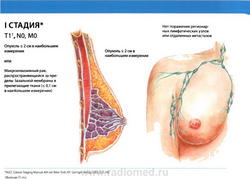
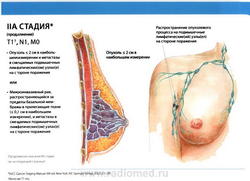
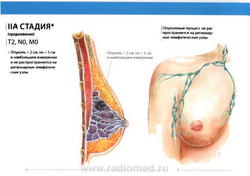
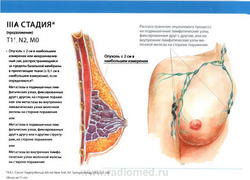
- T1: Размер опухоли в наибольшем измерении не более 2 см
- T1mic: микроинвазия размером не более 0,1 см в наибольшем измерении;
- T1a: размеры опухоли более 0,1 см, но менее 0,5 см в наибольшем измерении;
- T1b: размеры опухоли более 0,5 см, но менее 1,0 см в наибольшем измерении;
- T1c: размеры опухоли более 1,0 см, но менее 2,0 см в наибольшем измерении.
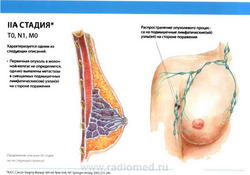
- T2: размеры опухоли более 2,0 см, но менее 5,0 см в наибольшем измерении.
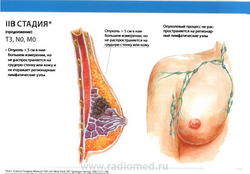
- T3: размеры опухоли более 5,0 см в наибольшем измерении.
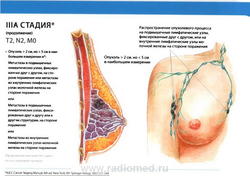
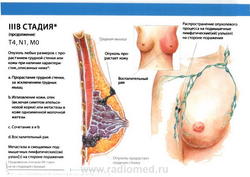
- T4: опухоль любого размера с прямым распространением на (а) грудную стенку или (b) кожу, как описано ниже:
- T4a: распространение на грудную стенку, за исключением грудных мышц;
- T4b: отек (включая «лимонную корку»), или изъязвление кожи молочной железы, или сателлитные узелки на коже пораженной молочной железы;
- T4c: сочетание признаков, характерных для T4a и T4b;
- T4d: воспалительная форма рака.
Регионарные лимфатические узлы (N)
- Nx: недостаточно данных для оценки состояния регионарных лимфатических узлов (например, если они были удалены ранее).
- N0: регионарные лимфатические узлы не поражены метастазами.
- N1: метастазы в подвижные (смещаемые) лимфатические узлы (узел) подмышечной области на стороне поражения.
- N2: метастазы в фиксированные (несмещаемые) или слившиеся в конгломерат лимфатические узлы подмышечной области на стороне поражения, или клинически* выявляемое поражение внутригрудных лимфатических узлов (узла) при условии отсутствия клинических* признаков поражения подмышечных лимфатических узлов
- N2a: метастазы в подмышечные лимфатические узлы, фиксированные друг к другу или к другим структурам;
- N2b: метастазы в клинически выявляемые внутригрудные лимфатические узлы (узел) при условии отсутствия клинических* признаков поражения подмышечных лимфатических узлов;
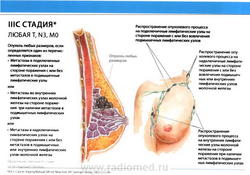
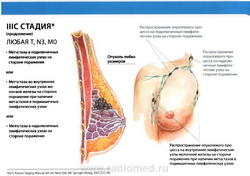
- N3: метастазы в ипсилатеральные подключичные лимфатические узлы (узел) независимо от вовлечения подмышечных лимфатических узлов, или метастазы в клинически выявляемые внутригрудные лимфатические узлы (узел) при условии наличия клинических* признаков поражения подмышечных лимфатических узлов (узла), или метастазы в ипсилатеральные надключичные лимфатические узлы (узел) независимо от статуса подмышечных и внутригрудных лимфатических узлов;
- N3a: метастазы в ипсилатеральные подключичные лимфатические узлы (узел);
- N3b: метастазы в ипсилатеральные внутригрудные и подмышечные лимфатические узлы (узел);
- N3c: метастазы в ипсилатеральные надключичные лимфатические узлы (узел).
* Клинически выявляемое поражение — диагностируемое с помощью осмотра или инструментальных методов исследования (за исключением
лимфосцинтиграфии).
Патологическая (постхирургическая) классификация (pN)*
- pNx: недостаточно данных для оценки состояния регионарных лимфатических узлов (например, если они не были удалены для патогистологического исследования или были удалены ранее).
- pN0: регионарные лимфатические узлы не поражены метастазами при гистологическом исследовании и при отсутствии дополнительного исследования на наличие изолированных опухолевых клеток (ITC — isolated tumor cell(s)).
Замечание: ITC представляет собой единичную опухолевую клетку или кластер клеток размерами не более 0,2 мм, выявляемый только на основании иммуногистохимического исследования или молекулярных методов. ITC не обнаруживает признаков злокачественности, т.е. пролиферации или стромальной реакции.
- pN0(I-): отсутствие метастазов в регионарных лимфатических узлах при гистологическом и иммуногистохимическом исследовании;
- pN0(I+): отсутствие метастазов в регионарных лимфатических узлах при гистологическом исследовании, при иммуногистохимическом исследованииразмер кластера не превышает 0,2 мм;
- pN0(mol-): отсутствие метастазов в регионарных лимфатических узлах при гистологическом и молекулярном (ОТ-ПЦР)** исследовании;
- pN0(mol+): отсутствие метастазов в регионарных лимфатических узлах при гистологическом исследовании, положительный результат при молекулярном исследовании (ОТ-ПЦР).**
* Классификация основана на исследовании подмышечных лимфатических узлов и/или сентинельного (сторожевого) лимфатического узла. Классификация, основанная на исследовании сторожевого лимфатического узла (если на этапе хирургического лечения не выполнялась лимфодиссекция подмышечных лимфатических узлов), должна обозначаться аббревиатурой (sn), например, pN0(I+) (sn).
** ОТ-ПЦР — обратная транскриптазно-полимеразная цепная реакция.
- pN1: метастазы в 1—3 подмышечных лимфатических узлах и/или внутригрудных лимфатических узлах с микроскопическим поражением, выявленным при исследовании сторожевого лимфатического узла, но не определяемым клинически**
- pN1mi: микрометастазы (размерами более 0,2 мм, но не более 2,0 мм);
- pN1a: метастазы в 1Р3 подмышечных лимфатических узлах;
- pN1b: метастазы во внутригрудных лимфатических узлах с микроскопическим поражением, выявленным при исследовании сторожевого лимфатического узла, но не определяемым клинически;**
- pN1c: метастазы в 1—3 подмышечных лимфатических узлах и внутригрудных лимфатических узлах с микроскопическим поражением, выявленным при исследовании сторожевого лимфатического узла, но не определяемым клинически.** При метастатическом поражении более трех подмышечных лимфатических узлов поражение внутригрудных лимфатических узлов классифицируется как pN3b.
- pN2: метастазы в 4—9 подмышечных лимфатических узлах или клинически* выявляемое поражение внутригрудных лимфатических узлов при условии отсутствия метастазов в подмышечных лимфатических узлах
- pN2a: метастазы в 4—9 подмышечных лимфатических узлах (при размере как минимум одного кластера более 2,0 мм);
- pN2b: клинически* выявляемое поражение внутригрудных лимфатических узлов при условии отсутствия метастазов в подмышечных лимфатических узлах.
- pN3: метастазы в 10 и более подмышечных лимфатических узлах, или в подключичных лимфатических узлах, или в клинически* выявляемых ипсилатеральных внутригрудных лимфатических узлах (узле) при условии наличия одного или более пораженных метастазами подмышечных лимфатических узлов, или при наличии более трех пораженных метастазами подмышечных лимфатических узлов при условии микроскопического метастатического поражения (выявленного при исследовании сторожевого лимфатического узла) в клинически интактных внутригрудных лимфатических узлах, или в ипсилатеральных надключичных лимфатических узлах
- pN3a: метастазы в 10 и более подмышечных лимфатических узлах (при размере как минимум одного кластера более 2,0 мм) или метастазы в подключичных лимфатических узлах;
- pN3b: метастазы в клинически* выявляемых ипсилатеральных внутригрудных лимфатических узлах (узле) при условии наличия одного или более пораженных метастазами подмышечных лимфатических узлов; или при наличии более трех пораженных метастазами подмышечных лимфатических узлов при условии микроскопического метастатического поражения (выявленного при исследовании сторожевого лимфатического узла) в клинически интактных внутригрудных лимфатических узлах;
- pN3c: метастазы в ипсилатеральных надключичных лимфатических узлах.
* Клинически выявляемое поражение — диагностируемое с помощью осмотра или инструментальных методов исследования (за исключением лимфосцинтиграфии).
** Клинически не выявляемое поражение означает не диагностируемое с помощью осмотра или инструментальных методов исследования (за исключением лимфосцинтиграфии).
Отдаленные метастазы (M)
- Mx: недостаточно данных для оценки отдаленных метастазов.
- M0: отдаленные метастазы отсутствуют.
- M1: отдаленные метастазы.
Группировка по стадиям
Stage 0
Т2
N3
N1,N2



Материал заимствован с сайта
К вопросу о диагностике заболеваний молочной железы, сопровождающихся синдромом втянутого соска.
Рожкова Н.И., Шевченко С.А., ФГУ «Российский научный центр рентгенорадиологии федерального агентства по здравоохранению и социальному развитию Российской Федерации» (г. Москва).
Резюме
В статье Н.И. Рожковой, С. А. Шевченко «К вопросу о диагностике заболеваний молочной железы, сопровождающихся синдромом втянутого соска» авторы определили круг заболеваний, входящих в этот синдром, уточнили патоморфологические механизмы втяжения соска, рассчитали эффективность методов лучевой диагностики при раздельном и комплексном их применении, разработали тактику наблюдения и показания к хирургическому лечению.
Проблема втянутого соска, несмотря на явные клинические проявления, остается сложной для установления причины его возникновения визуальными методами исследования.
Многообразие и сходство рентгенологических, сонографических и патоморфологических проявлений ряда заболеваний молочной железы, приводящих к втяжению соска, затрудняет правильность постановки диагноза и обусловливает высокую частоту ошибок на амбулаторно-поликлиническом этапе [1,3, 5, 7].
Среди общего потока больных втяжение соска встречается у 4,8% женщин старше 45 лет, из них врожденная патология - в 3,9% случаев, преимущественно у лиц молодого возраста, в 15% случаев изменения соска сопровождаются патологической секрецией [3,5]. Двусторонние изменения сосков наблюдается в 7,7% случаев [2,4].
Отсутствие системного мониторинга и четких критериев отбора больных на хирургическое лечение приводит с одной стороны к неоправданным дорогостоящим хирургическим вмешательствам с диагностической целью, что нередко вызывает развитие пролиферативных процессов в зоне послеоперационного рубца, с другой стороны -- больные остаются без адекватной медицинской помощи [1,2,6,7].
Возможности современных диагностических технологий, возникших на основе междисциплинарной интеграции, позволяют по-новому взглянуть на разработку путей повышения качества дооперационной диагностики заболеваний молочной железы, сопровождающихся втяжением соска, что и определило цель и задачи настоящего исследования [2 ].
Целью настоящей работы является повышение эффективности диагностики заболеваний, сопровождающихся синдромом втянутого соска, за счет расширения спектра возможностей современных достижений лучевой диагностики.
Для достижения поставленной цели были решены следующие задачи:
1.Провести анализ структуры заболеваний, сопровождающихся втяжением соска.
2.Разработать клинико-, рентгено-, соно-, патоморфологические симптомокомплексы, характерные для данных заболеваний.
3.Определить эффективность методов лучевой диагностики при раздельном и комплексном их применении.
4.Изучить механизмы втяжения соска при различных заболеваниях на основе патоморфологического исследования.
5.Определить место методов интервенционной радиологии, включая вакуумную аспирационную биопсию (ВАБ), в уточняющей диагностике.
6.Выработать диагностическую тактику и мониторинг наблюдения. Установить показания к хирургическому лечению больных с синдромом втянутого соска.
Материал и методы
Обследовано 1200 пациентов в возрасте от 17 до 80 лет в условиях специализированных маммографических кабинетов. Средний возраст составил 50.6±5,1. Выявлены различные патологические состояния, среди которых синдром втянутого соска был диагностирован у 201 больных (16,7%). Обследованные больные были разделены на 3 группы. Первая группа (контрольная группа) включала 55 (27,4%) женщин, не оперированных, с минимальными изменениями, определяемыми клинически и лучевыми методами диагностики, находившихся под наблюдением от 1 месяца до 1,5 лет. Вторую группу составили 102 (50,7%) больных, оперированных по поводу доброкачественных заболеваний. В третью группу вошли 44 (21,9%) пациентки, оперированные по поводу РМЖ. Деление на группы проводилось по результатам анализа клинико-, рентгено-, сонно-, патоморфологических данных.
Первым этапом обследования был клинический осмотр, пальпация, забор материала выделений из соска для цитологического исследования. На втором этапе применяли рентгенологическое исследование 159 (79%) больным на маммографе "Mammodiagnost UC" фирмы «Phylips», снабженном растром для усиления контрастности снимка и специальными кассетами с усиливающими экранами Min R Kodak. Использовалась односторонняя маммографическая синечувствительная пленка фирмы «Kodak» с автоматическим проявлением. Дополнительно применяли прицельную маммографию для уточнения характера изменений в молочной железе в 48 (24%) наблюдениях, снимки с прямым увеличением изображения в основном для характеристики микрокальцинатов - 31 (15%). При наличии патологической секреции применяли дуктографию в 20 (10%) наблюдениях. Пневмокистографию с диагностической и лечебной целью - 26 (13%) больным. При непальпируемых образованиях использовали внутритканевую маркировку у 29 (14%) больных. Ультразвуковое исследование молочных желез проводили женщинам с развитой железистой тканью на аппаратах HDI ATL 1000 фирмы «Phylips», отечественных аппаратах «Эходиаскан» и «Карис плюс» с использованием линейных датчиков с частотой 7,5 Мгц. Также УЗИ применяли при дифференциальной диагностике узловых образований, имеющих сходную рентгенологическую картину. Учитывая наличие предела возможностей традиционной сонографии в дифференциальной диагностике доброкачественной патологии и РМЖ, использовали цветовую допплерографию 150 (75%) больным. В спорных случаях диагностики применяли сцинтимаммографию с 99m Тс- технетрилом у 24(12%) больных.
На заключительном дооперационном этапе цитологическое или гистологическое исследование с применением новейших технологий интервенционной диагностики: ТАБ под УЗ - контролем (28% больных) или рентгенологическим контролем с применением миникомпьютера «Цитогайд» (19% больных), вакуумная аспирационная биопсия столбиков ткани на горизонтальном столе ABBI system (11% больных). При пальпируемых образований проводили аспирационную биопсию без визуального контроля 84 (41,8%) больным.
Результаты
В соответствии с задачами исследования проведен анализ заболеваний, сопровождающихся синдромом втянутого соска (201 наблюдений). Втяжение соска, обусловленного раком молочной железы с расположением узла вблизи соска, наблюдалось у 38 (19%) больных, рак Педжета - у 6 (3%), неспецифический нелактационный мастит - 30 (15%), узловой фибросклероз - 25 (12%), фиброаденома - 15 (8%), гинекомастия - 12 (6%), липогранулема - 5 (3%). Диагноз был подтвержден на основании патоморфологического исследования.
При клиническом обследовании уплотнение в молочной железе было выявлено у 84 (42%) женщин, в 117 (58%) - образования в молочной железе не пальпировались.
При выявлении пальпируемого образования в молочной железе клинически дифференцировать кисту, фиброаденому, рак, фибросклероз, липогранулему, гинекомастию и т.д. затруднительно. Это объясняется рядом причин, одной из которых является плотный окружающий фон за счет выраженной диффузной мастопатии, не позволяющий четко выявить различные клинические критерии, характерные для данных образований.
С целью уточнения диагноза всем больным проводилась маммография, что позволило в 86% обнаружить изменения в молочной железе. При этом разнообразие рентгенологической картины выявленных патологических образований, обусловленное вариабельностью гистологического строения, затрудняло дифференциальную диагностику, вследствие чего в 23% случаев заключение носило предположительный характер. В частности, у женщин молодого возраста в 13% наблюдений трудности диагностики были связаны с высокой плотностью окружающего фона за счет развитой железистой ткани. У данной категории больных наиболее информативно ультразвуковое исследование. Тем не менее, в 29% случаев сонография не выявляла патологии, что связано с инволютивным фоном и особенностью гистологического строения некоторых нозологических форм (узлового фибросклероза, некоторых форм РМЖ, липогранулем).
В контрольной группе (55 больных) преобладали пациентки с приобретенной патологией - (67%), врожденная патология встретилась у 34% женщин. Причинами втяжения соска был фиброз, развившийся после перенесенного не лактационного мастита (11 больных) (рис. 1) или кистозное расширение протоков, как результат лактационного мастита (26 больных) (рис. 2).
В данной группе не было выявлено каких-либо специфических рентгенологических или сонографических симптомов. Больные наблюдались от 6 до 18 месяцев без отрицательной динамики. Данная группа больных была выделена как пример того, что втяжение соска не всегда является признаком заболевания молочной железы.
Рак молочной железы клинически проявлялся болью в молочной железе в 59% случаев, шелушением кожи и мокнутьем соска - в 14%, кровянистыми выделениями из соска - в 4,5%. Уплотнение в молочной железе отчетливо дифференцировалось при рентгенологическом исследовании в 86%. Типичным рентгенологическим проявлением было затемнение средней интенсивности (59% больных) с нечеткими контурами (68%) и лучистостью по периферии узла (9%). Микрокальцинаты размерами от 50 до 500 микрон, неправильной формы были выявлены в 21% наблюдений. Уплотнение в виде сгущения и структурной перестройки рисунка железистого треугольника наблюдалось у 14% больных,
В 52% опухоль локализовалась за соском, мультицентрический процесс наблюдался в 7%. В 59% наблюдений расстояние до соска не превышало 1 см. Опухоли размерами 1-2 см втягивали сосок в 38,6% случаев. При УЗИ уплотнение в молочной железе в виде гипо- (46%) или анэхогенной структуры с пристеночными наложениями (5%) выявлялось в 50% наблюдений. Цветная допплерография, выявившая усиление сосудистого рисунка вокруг опухоли размерами 1-2см у 13 (29,5%) больных, усиление васкуляризации в опухолевом узле (при размерах более 2 см) в 3 (6,8%) наблюдениях. Сосуды в опухоли были извитыми и имели радиальную направленность.
Для уточняющей диагностики применялась сцинтимаммография с Тс99m технетрилом, выявившая очаг повышенного накопления РФП различной степени интенсивности. При отсроченном обследовании через 3 часа уровень вымывания РФП из очага был низким, что являлось косвенным критерием чувствительности опухоли к химиотерапии. В 3 наблюдениях определялась гиперфиксация РФП в аксиллярном лимфатическом узле.
Наиболее частой гистологической формой рака был инфильтрирующий протоковый рак (рис.3) (36%), дольковый рак встречался в нашем исследовании в 9% наблюдений.
В группе доброкачественных заболеваний приоритетным методом диагностики являлась маммография, выявляющая от 65% до 95% патологии. УЗИ как вспомогательный метод диагностики дополнял дифференциально - диагностическую информацию об образованиях в молочной железе в 87% наблюдений. С помощью этого метода была установлена структура образований, а при помощи допплерографии проводилась дифференциальная дооперационная диагностика. Сцинтимаммография также позволила на 16% повысить эффективность диагностики доброкачественных заболеваний молочной желез, сопровождающихся втянутым соском. Наибольшие трудности возникли при диагностике диффузной формы мастита, узловом фибросклерозе, интраканаликулярной фиброаденоме. Комплексное использование различных методов визуализации, ТАБ и ВАБ с последующей цитологической и гистологической верификацией позволили поставить правильный дооперационный диагноз в 98% случаев (рис 4).
Анализ эффективности различных методов диагностики представлен в табл. 1.
Таблица 1
Оценка эффективности маммографии и сонографии при раздельном и комплексном их применении в группе доброкачественных и злокачественных опухолей молочной железы
Доброкачественная
патология
Злокачественная
патология
МГ
УЗИ
МГ+ УЗИ
МГ
УЗИ
МГ+
УЗИ
Специфичность
62
46
67
73
33
86
Чувствительность
91
76
98
82
58
97
Точность
84
67
95
80
53
96
Наибольшей специфичностью, чувствительностью и точностью, как в группе доброкачественных заболеваний, так и при РМЖ, обладала маммография
Тактика наблюдения при втяжении соска определена на основе анализа результатов динамического наблюдения, что позволило создать систему мониторинга. При отсутствии данных за дисплазию и пролиферацию - динамическое наблюдение 1 раз в 6 месяцев или 1 раз в год при положительной динамике от консервативной терапии.
Больные были оперированы в разные сроки после выявления образования: от одной недели до 1,5 лет по различным показаниям. Было проведено 102 секторальные резекции по поводу доброкачественных заболеваний молочных желез (из них 13 малых секторальных резекций на установке ABBI system), 35 мастэтомий по Маддену и 9 расширенных секторальных резекций с подмышечной лимфоаденэктомией при раке молочной железы.
Таким образом, хирургическое лечение при заболеваниях молочной железы, сопровождающихся втяжением соска, показано в следующих случаях:
1. при клинических, рентгенологических. сонографических, цитологических данных за рак;
2. при отсутствии данных за рак по данным визуальных методов обследования, но при подозрении на рак при цитологическом исследовании;
3. при наличии микрокальцинатов с наличием узлового образования или при скоплении микрокальцинатов без узла и подозрительных данных за рак при проведении аспирационной биопсии;
4. при наличии отрицательной динамике доброкачественных образований в виде увеличения размеров, изменения контуров, при наличии пристеночных разрастаний в кистах, появления признаков пролиферации и атипии по данным цитологического исследования;
5. при выявлении кровянистых выделений из соска, данных за внутрипротоковые разрастания при дуктографии, даже без цитологического подтверждения рака;
Заключение1. Установлено многообразие заболеваний, приводящих к втяжению соска, доброкачественной природы: неспецифический мастит (14,9%), очаговый фибросклероз (12,4%), патологическая секреция, проявляющаяся внутрипротоковыми кистами или папилломами (7,5%), фиброаденомы(7,5%), гинекомастия (5,9%), олегранулема (2,5%) и злокачественной природы: рак Педжета (2,9%), инфильтрирующий протоковый рак (10,4%), инфильтрирующий и не инфильтрирующий дольковый рак (2,8%).
2. Разработанные клинико-рентгено-соно-патоморфологические симптомокомплексы на основе лучевых (неинвазивнх и инвазивных), включая ВАБ, патоморфологических, радиоизотопных методов исследования позволяют на дооперационном этапе осуществлять комплексную уточняющую диагностику заболеваний молочной железы, сопровождающихся втяжением соска, с точностью 98%.
3. Анализ преимущества и ограничений различных методов рентгенологической, ультразвуковой, радионуклидной, патоморфологической диагностики позволили разработать систему мониторинга и показания к хирургическому лечению при синдроме втянутого соска.
4. Внедрение в практическое здравоохранение новых технологий диагностики патологии молочных желез (ВАБ) позволяет избежать затратные и травматичные хирургические операции в 16% случаев.
5. Впервые уточнены и систематизированы механизмы втяжения соска на основе тщательного патоморфологического исследования. Так, фиброз околососковых структур был выявлен в 43,2% наблюдений, воспалительный инфильтрат - в 22,9%, опухолевый инфильтрат - в 21,9%, их сочетание - в 12,9%.
Рак Педжета составляет от 0,5 до 5% всех случаев неоплазии молочной железы. Чаще данная патология диагностируется в постменопаузе (пик между 50 и 60 годами). Средний возраст больных составляет 54 года; это на 5-10 лет меньше, чем при инфильтративном протоковом раке. Первые наиболее систематизированные сведения о раке Педжета относятся к XIX веку.
В 1856 г. S. Velpeau впервые описал изменения сосково-ареолярного комплекса (эритема, экзематозные изменения и т.д.), характерные для данной формы рака. Однако лишь в 1874 г. J. Paget отметил связь между этими изменениями и карциномой молочной железы. Автор на основании 15 наблюдений показал, что у всех пациенток с подобными поражениями сосково-ареолярного комплекса в течение ближайшего года развился рак молочной железы (РМЖ). Объясняя механизм возникновения подобной патологии, автор предположил, что поверхностные воспалительные изменения влияют на подлежащие структуры, последующие дегенеративные изменения в которых способствуют появлению неоплазии.
Классическое описание клинической картины болезни, данное J. Paget, и последующее описание им возможного механизма ее развития позволило G. Erichsen в 1876 г. назвать данную патологию «болезнью (раком) Педжета соска молочной железы».
В отечественной литературе первое описание «болезни Педжета соска» принадлежит А.И. Поспелову (1894). Тщательным изучением этой формы процесса в начале XX столетия занимались М.А. Членов и В.Л. Боголюбов, дополнившие описанную J. Paget клиническую картину новыми патогномоничными симптомами.
Наиболее значимым исследованием рака Педжета молочной железы (РПМЖ) была работа Jacobeus (1904), в которой автор определил данное заболевание как внутрипротоковый рак. Однако существовало мнение, что указанное состояние является предраковым или раком апокриновых желез, дегенеративным изменением хронических кожных процессов и т.д. Только после идентификации G.Thin злокачественной природы клеток Педжета сложилась так называемая эпидермо-тропная теория РПМЖ.
Гистогенез РПМЖ
Эпидермотропная теория развития данной формы рака опирается на тот факт, что клетки Педжета по происхождению являются клетками протокового рака, мигрирующими вдоль базальных мембран протоков в эпидермис соска. Подтверждением данного факта могут служить, во-первых, присутствие внутрипротоковой или инвазивной карциномы у большинства больных, во-вторых - общность иммунологических реакций, демонстрируемая клетками Педжета и инфильтративного протокового рака, определенная иммуно-гистохимически. Проведенный анализ с антигенами мембран (цитокератин, казеин, раково-эмбриональный антиген, глобулы молочного жира - HMFG 1 и 2, лектины и др.) показал родство клеток Педжета с клетками РМЖ. С обнаружением факта гиперэкспрессии онкопротеина c-erbB-2 в клетках Педжета появилась гипотеза о наличии хемотаксического фактора, который секретируется эпидермальными кератиноцитами, стимулируя клетки Педжета к распространению по эпидермису. Онкопротеин c-erbB-2 гиперэкспрессируется приблизительно в 20% случаев инвазивного РМЖ, в 50% - протокового рака in situ и в 90-100% случаев РПМЖ. Онкобелок c-erbB-2 стимулирует пролиферацию и, что более важно, увеличивает подвижность раковых клеток путем взаимодействия экспрессируемых в мембранах белков c-erbB-2 с факторами подвижности, секретируемыми, вероятнее всего, эпидермальными кератиноцитами. Это способствует хемотаксису и инвазии эпидермиса клетками Педжета, в итоге приводя к распространению клеток Педжета по эпидермису.
In situ трансформирующая теория предполагает малигнизацию или дегенерацию уже существующих клеток, определяя клетки Педжета как злокачественные кератиноциты, возникающие in situ. Согласно этой теории, РПМЖ - независимый процесс, поражающий эпидермис соска и подлежащую ткань молочной железы.
Подтверждения такому взгляду получены при электронной микроскопии, показавшей наличие микроворсинок и десмосомальных взаимодействий между кератиноцитами и клетками Педжета. Помимо этого, были обнаружены аномальные клетки с чертами, характерными как для кератиноцитов, так и для клеток Педжета, что может свидетельствовать об их переходном или трансформационном состоянии. Подобные наблюдения патогенетически объясняют те ситуации, когда узел в молочной железе находится на значительном отдалении от центральной (сосково-ареолярной) зоны.
Первое гистологическое описание болезни Педжета соска принадлежит Butlin (1876). Микроскопически клетки Педжета большие, круглые или овальные, интраэпидермальные, не образующие межклеточных мостиков с соседними шиповатыми клетками, обычно с просветленной цитоплазмой, увеличенным плеоморфным и гиперхроматическим ядром, различимыми, но не ярко окрашенными ядрышками. Довольно часто видимы митозы. Клетки Педжета могут лежать одиночно, преимущественно вдоль базально-эпидермальных клеток, с тенденцией к уплощению (при расположении на поверхности) или с образованием небольших своеобразных гнезд, сходных с протоковыми или железистыми структурами. Количество клеток значительно варьирует - от нескольких изолированных до полного замещения части эпидермального слоя. Эпидермальные клетки вокруг групп клеток Педжета подвергаются компрессионной атрофии. Дерма также подвергается изменениям - она гиперемирована, инфильтрирована плазмоцитами, в ней формируются новые капилляры, происходит серозная экссудация, что и приводит к формированию типичной клинической картины.
Цитоплазма клеток Педжета обычно положительно реагирует на Periodic-Acid-Schiff (PAS) и устойчива к диастазу, что свидетельствует о присутствии нейтральных полисахаридов и помогает дифференцировать РПМЖ с некоторыми формами злокачественных меланом и первичными интраэпидермальными карциномами. Клетки Педжета дают положительную реакцию с раково-эмбриональным антигеном CEA. Следует также отметить, что в большинстве случаев болезни Педжета (более 90%) наблюдается гиперэкспрессия онкобелка c-erbB-2. Чаще всего встречается корреляция между положительной реакцией с онкопротеином c-erbB-2 и присутствием рака in situ или другого рака. В большинстве случаев (более 90%) РПМЖ представлен раком in situ либо инвазивным раком с узлообразованием, который может характеризоваться мультицентрическим ростом. При отсутствии опухолевого узла наиболее часто встречаются неинвазивные изменения (ductal carcinoma in situ - более 90 %), в то время как наличие опухолевого узла очень часто связано с инвазивным процессом. В ряде исследований показано, что частота инфильтративной карциномы в удаленных препаратах составляет 19%, тогда как при наличии опухолевого узла эта цифра возрастает до 90%. Для больных раком Педжета in situ не характерно локорегионарное прогрессирование. Метастатические изменения регионарных лимфатических узлов отмечены в 45% случаев при наличии опухолевого узла. По гистологическому подтипу РПМЖ наиболее часто ассоциируется с солидной и угревидной формами внутрипротоко-вой карциномы. Эта форма считается наиболее биологически агрессивной, с высокими пролиферативной активностью и амплификацией протоонкогена c-erbB-2.
Клинические проявления. Исходное описание рака Педжета за последние 100 лет не изменилось. Данная форма наиболее часто встречается как ограниченные изменения соска и ареолы пораженной молочной железы. Билатеральным поражение бывает редко; сегодня известно только 3 случая РПМЖ, возникшего сразу в 2 сосках.
Большинство женщин отмечают некоторые изменения чувствительности соска и ареолы; наиболее часты жалобы на зуд, жжение. При контакте с одеждой возможны небольшая мацерация или (реже) более серьезные изменения (до кровотечения и экссудации с пораженной поверхности соска и ареолы). Поверхностные изменения медленно прогрессируют, приводя к экзематозному поражению как ареолы, так и соска. Экзематозным изменениям может также подвергаться кожа молочной железы. Обычно область экзематозного поражения немного приподнята и четко отграничена от непораженной кожи, сосок изменен и втянут.
В литературе описаны случаи временного ослабления экзематозных изменений как при местном использовании кортикостероидных препаратов, так и без видимой причины, что в целом приводило к более позднему установлению правильного диагноза и отсрочке адекватного лечения. Объективно шелушение и эритематозные изменения ареолы и соска встречаются наиболее часто. Первоначально практически всегда поражается сосок, затем ареола, в последующем в патологический процесс вовлекается окружающая кожа (довольно редко).
На более поздних стадиях РПМЖ наблюдаются изъязвление и деструкция сосково-ареолярного комплекса. На этом этапе возможны обильные кровянистые выделения из пораженных участков. Помимо этого, отмечается втяжение соска, однако наиболее часто происходит его уплощение (результат роста подлежащей опухоли). Эти клинические особенности составляют симптомокомплекс, отличающий РПМЖ от инфильтративно-отечных форм, для которых характерна диффузная эритема молочной железы, а изменения кожи соска и ареолы носят вторичный характер.
Необходимо также отметить, что РПМЖ может протекать асимптомно и не подтверждаться при клинических исследованиях. Диагностика в таких случаях базируется на данных гистологического исследования.
Определены 3 варианта изменений при данной форме рака:
Примерно у 50% пациенток в молочной железе может обнаруживаться пальпируемое опухолевое образование; при этом примерно в 90-94% случаев диагностируется инвазивный рост и у 1/2-2/3 больных имеются метастазы в лимфатические узлы. При отсутствии пальпируемого опухолевого образования у больных определяется неинвазивная форма болезни (66-86% случаев РПМЖ in situ).
Опухолевый узел может не быть связан с соском; иногда встречаются случаи, когда изменения в соске и ареоле могут подвергаться редукции, в то время как неопластический процесс в ткани органа прогрессирует.
РПМЖ может встречаться и у мужчин. Клинические его проявления в этом случае сходны с таковыми у женщин. Правильный диагноз у мужчин устанавливают гораздо позже, поскольку РМЖ для них не является типичным заболеванием. Хорошо видимые эритема, шелушение, эрозии с поражением протоков, жалобы на кожный зуд в области ареолы и соска - это характерная клиническая картина РПМЖ у мужчин. Наиболее частыми клиническими признаками являются экзематозные изменения и изъязвление соска и ареолы (71%), пальпируемое увеличение аксиллярных лимфатических узлов (54%), пальпируемое опухолевое образование в молочной железе (43%), изменение соска и кровотечение (40%), зуд (14%), боли (14%), уплотнение (11%).
Диагностика РПМ
Маммография. Чувствительность метода в определении злокачественных новообразований молочной железы значительно возрастает при наличии опухолевого узла (97%), в то время как при его отсутствии она не превышает 50%. Необходимо выполнение билатеральной маммографии, что позволяет выявить и локализовать такие подозрительные изменения, как наличие участков с микрокальцинатами, а также исключить мультицентричность поражения. При маммографическом исследовании следует обратить внимание на толщину кожи в области соска и ареолы, степень втянутости соска, наличие субареолярного или более диффузного скопления микрокальцинатов, а также определить размер и локализацию опухолевого узла. Хотя РПМЖ ограничен лишь поражением соска и ареолы, важно выполнить маммографическое исследование всей железы во всех проекциях, так как довольно часто эта патология сочетается с опухолевым узлом иной гистологической структуры. УЗИ успешно применяется и может быть включено в первичный план обследования, особенно при отрицательных данных маммографии. Описаны случаи, когда изменения, не видимые при маммографическом исследовании, визуализировались при УЗИ. Магнитно-резонансная томография (МРТ). Данный метод чрезвычайно перспективен для визуализации изменений в соске, клинически еще не обнаруживаемых. Помимо прочего, МРТ позволяет отличить нормальный сосок от пораженного, отдифференцировать опухоли в тканях ареолы от опухолей с вовлечением центрального отдела молочной железы (сосок и ареола).
Когда клинически наблюдается изменение области соска и ареолы, для постановки правильного диагноза необходима биопсия соска и ареолы на всю толщину. Поставить правильный диагноз помогает также взятие соскоба с пораженной области, однако точность этой методики зависит от квалификации цитопатолога. В настоящее время для подтверждения диагноза применяются реакции с раково-эмбриональным антигеном (CEA), муцином и протеином c-erbB-2. Иммуногистохимические исследования с использованием цитокератина эпителиального мембранного антигена (ЭMA) и онкобелка c-erbB-2 в значительной мере облегчают дифференциальную диагностику. Однако негативного ответа недостаточно для исключения диагноза РПМЖ, поэтому для окончательного диагноза необходима открытая биопсия. Значительное сходство внешних проявлений РПМЖ с кожными заболеваниями, отсутствие у врачей общей практики необходимых знаний и подозрения на раковую природу таких изменений у здоровых молодых женщин часто приводят к неверному диагнозу. До последнего времени при РПМЖ обычной была длительная отсрочка (примерно на 10- 12 мес) правильного диагноза и начала лечения.
Рак молочной железы и беременность.
Рак молочной железы - наиболее частая форма опухолей, диагностируемых во время беременности. Колебания частоты рака молочной железы, ассоциированной с беременностью от 1 клинического случая на 1360 до 1 на 3200 женщин.
Среди новорожденных девочек приблизительно у 10% рак молочной железы весьма вероятно возникнет на фоне беременности. До 7,3% женщин, моложе 45 лет, страдающих раком молочной железы, являются беременными или кормящими.Приблизительно 70-80% беременных женщин имеют узловую форму рака молочной железы.
Диагностика рака во время беременности - скорее исключение, чем правило, так как:
Поскольку, в силу ряда особенностей, маммографическое исследование иногда с трудом интерпретирует данные, возможно более широкое применение ультразвукового метода, особенно с доплерографией .
Во всех случаях наличия узлового образования необходимым мероприятием является пункционная биопсия либо трепан-биопсия (может быть открытая биопсия) под местной анестезией. Этот метод диагностики:
Лечебные мероприятия должны учитывать:
Хирургическое вмешательство под общим обезболиванием возможно, начиная с конца I триместра. При необходимости секторальная резекция выполняется под местной анестезией.
Лучевая терапия, в силу своей опасности для плода, во время беременности не проводится. Причины опасности следущие:
Если лучевая терапия все-таки проводилась в I триместре беременности, следует рекомендовать пациентке искусственное прерывание беременности. Химиотерапия может применяться в течение второго и третьего триместра беременности. В случае абсолютной необходимости незамедлительного начала лечения, но при раннем сроке беременности необходимо убедить пациентку в неизбежности прерывания протекающей беременности.При этом важен выбор препаратов: наименьшим повреждающим действием обладают винкаалколоиды (Винкристин, Винбластин) и антрациклины (Доксорубицин). Циклофосфан может быть использован, т.к. его токсичность при данных условиях незначительна (схема АС).Наименее предпочтительно включение в схемы лечения Метотрексата и 5-фторурацила, обладающих значительным повреждающим действием.
Побочные эффекты таксанов изучаются. Тамоксифен, обладающий выраженной тератогенностью, при беременности не применяется; может быть использован при рецепторположительных опухолях у больных раком молочной железы, ассоциированным с беременностью, после родов.
Основными вариантами лечения пациенток могут считаться:
При локализованном раке молочной железы
При местнораспространенном раке молочной железы, диагностируемом в раннем сроке, возможно:
Лечение диссеминированного рака молочной железы, ассоциированного с беременностью, в большей степени учитывает «интересы» плода.Это всегда трудное решение, базирующееся на оценке степени распространенности процесса, срока протекающей беременности и биологических особенностей опухоли в каждом конкретном случае.
Заключение
Рак молочной железы, ассоциированный с беременностью, - сложная клиническая и диагностическая проблема;
Результаты ранней диагностики далеки от совершенства;
Использование полноценного диагностического алгоритма у данных пациенток необходимо, поскольку позволит адекватно оценить степень распространенности опухолевого процесса и выбрать эффективное лечение;
Прерывание беременности не является столь уж необходимым инициальным моментом комплексной терапии.
Авторы: доктор мед.наук И.В.Высоцкая, кандидат мед.наук А.Параконная, доктор мед.наук В.П.Летягин, кандидат мед.наук А.Д.Зикиряходжаев, доктор мед. наук Е.М.Погодина. Кафедра онкологии Российского онкологического научного центра им. Н.Н. Блохина РАМН
У мужчин рак молочной железы встречается примерно в 100 раз реже, чем у женщин.
В основном эта патология у мужчин обнаруживается после 60-70 лет, однако может регистрироваться в любом возрасте (от 9 до 90 лет), средний возраст - 55,8 года.
Благодаря анатомическому строению молочной железы, у мужчин минимальные проявления болезни можно выявить даже при обычной пальпации, однако ранние стадии рака диагностируются лишь у 34% пациентов. У 56% больных первично диагностируют местно-распространенный или диссеминированный рак молочной железы. Подобная ситуация, возможно, связана, с одной стороны, с отсутствием необходимой информированности у самих пациентов, с другой - с недостаточной онкологической настороженностью врачей общего профиля. По данным проф. В.П. Летягина и соавт., правильный диагноз при первичном обращении не был поставлен у 20% пациентов.
По данным разных авторов 6-30% больных связывает начало заболевания с травмой, у 7-27% в анамнезе имелось указание на наличие злокачественной опухоли молочной железы у прямых родственников первого и второго поколения, 12-40% страдали гинекомастией. Диагностика рака молочной железы в данном случае наиболее затруднительна.Самым частым клиническим симптомом болезни является наличие опухоли в молочной железе. Поскольку основная масса новообразований локализуется в субареолярной зоне, примерно у половины больных на момент обращения обнаруживается симптом втяжения соска. Выделения из соска (от серозных до кровянистых) встречаются относительно редко. Фиксация кожи над опухолью наблюдается примерно у 1/3 больных (симптомы «умбиликации», «площадки», «лимонной корочки» и т.п.). У такого же количества больных на момент выявления рака молочной железы определяется изъязвление кожи над опухолью. Относительно редко (примерно у каждого 7-го пациента) наблюдается фиксация опухоли в большой грудной мышце.
Болезненные ощущения в молочной железе - непостоянный симптом рака молочной железы у мужчин, однако в большинстве случаев именно он заставляет обратиться за медицинской помощью. При первичном обращении примерно у каждого 2-го пациента выявляются увеличенные аксиллярные лимфатические узлы. Однако достоверность клинической оценки состояния подмышечной области невысока: показатель ложно-положительных результатов колеблется от 8 до 50%.Диагностический алгоритм первичного обследования пациентов с опухолью молочной железы аналогичен таковому у женщин. Он включает в себя пальпаторный осмотр, маммографию и УЗИ, применяемые в комплексе, пункционную биопсию для цитологической верификации диагноза.
Диагностическая ценность рентгенологического исследования (маммографии) в данной клинической ситуации несколько ниже, чем при обследовании женщин (80-90% против 96%). Это связано с анатомическими особенностями строения мужской молочной железы. Поэтому одновременное использование ультразвуковой компьютерной томографии (УЗКТ), особенно с допплерографией, значительно повышает качество и результативность исследования.Для оценки распространенности и наличия отдаленных метастазов проводят рентгенологическое исследования легких, УЗКТ брюшной полости, сканирование костей скелета и определение сывороточной концентрации антигена СА 15- 3.
В целом биологические особенности течения опухолевого процесса при "мужском" раке молочной железы аналогичны таковым при раке этой локализации у женщин.
К наиболее важным прогностическим факторам относятся:
Алгоритм выбора первичной терапии, как и при «женском» раке молочной железы, базируется на оценке степени распространенности процесса. При начальных стадиях (I-IIА без поражения регионарных лимфатических узлов) можно ограничиться хирургическим вмешательством в объеме радикальной мастэктомии с сохранением обеих грудных мышц. Сохранные оперативные вмешательства при раке молочной железы у мужчин не применяются. Назначение системного лекарственного лечения при ранних формах целесообразно только при наличии отрицательных прогностических факторов, а послеоперационной лучевой терапии - только при высокой вероятности локального рецидива.
С 1957 по 2000 г. в клиниках РОНЦ им. Н.Н.Блохина РАМН находились на лечении 188 мужчин, страдающих раком молочной железы различной стадии. Средний возраст пациентов составил 57,4 года (табл.1).
Таблица 1. Распределение больных в зависимости от степени распространенности опухолевого процесса
I-IIA стадия процесса была у 34 (18%) пациентов, IIБ стадия - 30 (15,9%), местнораспространенный рак диагностирован у 88 (46,8%) больных, первично-генерализованный - у 24 (12,7%).
При анализе первичных проявлений рака молочной железы у мужчин отмечено, что наиболее частыми симптомами были: узловое образование в молочной железе, деформация сосково-ареолярной области, изменения кожи над опухолью, изъязвление кожи, отечность железы.
Хирургическое лечение получили 25 (13,3%) пациентов, комбинированное - 62 (35%), комплексное - 77 (41%) больных и консервативное - 24 (12,7%).
Наиболее частым методом оперативного вмешательства была радикальная мастэктомия (РМЭ) с сохранением одной или обеих грудных мышц (57,6%). Все остальные виды операций использовались значительно реже (табл.2).В связи с большими размерами опухолевого узла при отсутствии кожных проявлений основным методом неоадъювантного лечения была лучевая терапия по методике укрупненного фракционирова-ния дозы (44,1%).
Таблица 2. Виды оперативных вмешательств у 165 мужчин, больных раком молочной железы
При III стадии процесса лучевая терапия по методике обычного фракционирования дозы (СОД-40 Гр, РОД-2 Гр) чаще сочеталась с неоадъювантной химиотерапией или химиогормонотерапией.
Адъювантное лечение проведено 104 больным (табл.3). Наиболее часто в качестве адъювантного лечения использовалась химиотерапия (92% больных), в 51% случае при рецепторположительных опухолях она сочеталась с гормонотерапией. При внутренней или центральной локали-зации опухолевого узла в послеоперационном периоде лечение дополнялось лучевой терапией на парастернальную зону (18,3%).
Изучение уровня стероидных гормонов в опухоли позволило установить более высокие показатели по сравнению с таковыми у женщин. Кроме того, не обнаружено связи высокого уровня рецепторов с возрастом больных. В качестве гормонотерапии при рецепторположительных опухолях применяли антиэстрогенный препарат тамоксифен (20мг/сут, длительно).
Таблица 3. Виды адъювантного лечения
Примечание: х/т - химиотерапия, г/т - гормонотерапия, л/т - лучевая терапия.
При анализе отдаленных результатов обращают на себя внимание высокие показатели 10-летней выживаемости у больных с I-IIА стадией рака молочной железы (91,5%), а также высокая 5-и 10-летняя выживаемость больных IIБ стадией заболевания, достигшая 90,3 и 72,5%. Показатели выживаемости при IV стадии заболевания составили 9,7% и 3,2% соответственно.
Таким образом, при изучении особенностей течения рака молочной железы у мужчин установлено следующее:
Авторы: профессор В.П.Летягин, профессор И.В. Высоцкая, кандидат медицинских наук А.Д. Зикиряходжаев
Материал взят из журнала "Вместе против рака", №3, 2005г.
Узловатые формы РМЖ
Узловатые формы РМЖ встречаются наиболее часто. Пальпаторно определяется довольно четко очерченное, округлое, плотное новообразование с мелко- и крупнобугристой поверхностью, ограничено подвижное по отношению к ткани железы в связи с инфильтрацией окружающих тканей. Они делятся в зависимости от наличия или отсутствия инфильтрации окружающих структур на местноинфильтративно и отграничено растущие.
Отечно-инфильтративный рак
Молочная железа увеличена, уплотнена, кожа ее (нередко и сосок с ареолой)утолщена и отечна, имеет вид «лимонной корки». При этом отдельные опухолевые узлы не определяются. Отек обусловлен сдавлением опухолевым инфильтратом лимфатических путей самой железы или их блокадой метастатическими эмболами.
Панцирный рак
Характеризуется опухолевой инфильтрацией, как самой железы, так и кожи. Последняя становится плотной, пигментированной, плохо смещается. Могут появляться многочисленные внутрикожные опухолевые узлы; при отсутствии лечения они изъязвляются и покрываются корками. В дальнейшем молочная железа уменьшается, подтягивается кверху, сморщивается - как бы покрыта панцирем из уплотненной инфильтрированной кожи
Рожистоподобный рак
Кожа молочной железы резко гиперемирована, наблюдаются пятна с неровными языкообразными краями, напоминающие очаги рожистого воспаления. Покраснение обусловлено распространение опухолевых клеток по капиллярам и лимфатическим сосудам и компенсаторным расширением последних (карциноматозный лимфангит). Чаще всего заболевание протекает остро, с болевым синдромом и повышением температуры, но боль и температура меньше, чем при рожистом воспалении.
Для этой формы рака характерны высокая злокачественность, быстрое метастазирование. В случае выполнения мастэктомии вскоре появляются рецидивы, которые возникают из опухолевых клеток и эмболов в кожных и подкожных лимфатических сосудах.
Маститоподобный рак
Чаще имеет более бурное течение. Молочная железа значительно увеличена, напряжена, плотна, гиперемирована, отмечается локальное повышение температуры. В глубине железистой ткани могут прощупываться диффузные уплотнения. Процесс быстро распространяется, переходит на всю железу, может сопровождаться повышением температуры.
Рак Пэджета
В области соска и ареолы у женщин может встречаться своеобразный вид рака - болезнь Педжета (или рак Педжета). Сосок и ареола при этом, а также и прилегающая кожа превращаются в мокнущую поверхность с неровными слегка утолщенными валикообразными краями (типа эрозии или язвы) или покрытую сухими корочками. Поскольку до определенного времени сам опухолевый узел в молочной железе не определяется, многие принимают этот процесс за кожное заболевание и пытаются безуспешно лечить его различными наружными средствами, в том числе гормональными мазями.
Клинические признаки рака молочной железы.
Различают 3 формы рака молочной железы:
1.Узловая
2.Диффузная
3.Болезнь Педжета
Наиболее частой формой рака молочной железы является узловая. Узловая форма проявляется по-разному в зависимости от стадии процесса. Клиническим проявлением этой формы является появление плотного узла в том или ином участке молочной железы, который прощупывается уже при величине 1 см, если она расположена близко под кожей, чаще 2 см. Опухоль имеет плотную консистенцию, бугристую поверхность, безболезненна, ограниченно смещается по отношению к тканям самой молочной железы. Наиболее часто поражаются верхненаружные квадранты, поражение правой и левой молочных желез встречаются почти одинаково.
При попытке взять кожу над опухолью в складку появляется втяжение (симптом площадки) или морщинистость. При дальнейшем росте опухоль, прорастая кожу, может вызвать более глубокое её втяжение (симптом умбиликации), деформацию молочной железы, отёк (симптом лимонной корки над опухолью или за её пределами), втяжение соска; нередко утолщается сосок, наблюдается отёк ареолы (симптом Краузе). Выявляются наличие одиночных или нескольких плотных, округлых, безболезненных узелков в подмышечной впадине той же стороны.
Дальнейшее развитие опухоли ведёт к полному прорастанию кожи, вследствие чего могут возникнуть изъязвление и распад опухоли. Образуется обширная язва с вывороченными плотными и бугристыми краями, глубоким, легко кровоточащим дном, покрытым грязно-серыми некротическими тканями со зловонным запахом. Язва постепенно увеличивается, углубляется, вплоть до поражения рёбер, грудины. Появляются разрушение кости и сильная боль.
Диффузная форма.
В некоторых случаях опухоль растёт в виде диффузного инфильтрата, который пронизывает молочную железу во всех направлениях. Выделяют несколько форм диффузного рака молочной железы:
1.Рожистоподобная. По клинической картине напоминает рожистое воспаление. Молочная железа отёчна, увеличена, отмечается диффузное покраснение кожи молочной железы, покраснение распространяется за пределы молочной железы на грудную стенку. Однако, в отличие от рожистого воспаления, температура кожи если и бывает повышенной, то незначительно. Определяются подмышечные лимфоузлы, которые приобретают округлую форму, безболезненны.
2. Маститоподобная форма характеризуется наличием в молочной железе плотного инфильтрата без чётких границ с отёком тканей и гиперемией кожи. В отличие от истинного мастита, при этой форме рака не бывает высокой температуры, увеличенные регионарные лимфоузлы безболезненны. Могут возникнуть очаги распада с присоединением вторичной инфекции, что представляет большие трудности для дифференциальной диагностики.
3.Панцирная форма - молочная железа уменьшается, деформируется и становится значительно меньше здоровой. Она плотная, бугристая.
4.Отёчно-инфильтративная форма характеризуется наличием в молочной железе плотного инфильтрата, который не имеет чётких границ. Ей свойственны отёк кожи, увеличение молочной железы, которая свисает ниже здоровой. Кожа имеет вид лимонной корки. В подмышечных зонах могут определяться большие плотные лимфоузлы.
Болезнь Педжета.
Встречается в 0,5 - 3% случае рака молочной железы. Заболевание протекает сравнительно медленно и может длиться несколько лет. Начинается с покраснения и утолщения соска, появления сухих и мокнущих корочек и струпиков. При отпадении последних обнаруживается влажная, зернистая поверхность. В начальных стадиях эта форма опухоли мало чем отличается от банальной экземы, но в отличие от экземы болезнь Педжета не поддаётся лекарственному лечению. С течением времени идёт распространение на ареолу, сосок постепенно уплощается, изъязвляется, процесс распространяется на кожу молочной железы за пределы ареолы. Инфильтрация переходит на подкожную клетчатку и ткань молочной железы, определяются увеличенные метастатические лимфоузлы в подмышечной впадине.
Метастазы в кости рака молочной железы: механизм развития, осложнения, современный взгляд на сочетание бисфосфонатов и лучевой терапии.
Большакова С.А.,ФГУ «Российский научный центр рентгенорадиологии» Минздравсоцразвития РФ, г.Москва.
Введение
Рак молочной железы (РМЖ) является одной из ведущих причин онкологической смертности среди женщин. В случае диагностики заболевания на этапе регионарного метастазирования уровень 5-тилетней выживаемости составляет 83%, при наличии отдаленных метастазов он составляет 26% [1].
Костные метастазы довольно часто встречаются у пациентов с диссеминированной формой РМЖ, бывают остеолитические, остеобластические и смешанные. Эти процессы являются результатом разбалансировки между остеобластными медиаторами костной формации и остеокластными медиаторами костной резорбции. При раке молочной железы в 80% случаев выявляются остеолитические очаги [2], они характеризуются увеличением активности остеокластов и ускорением деструктивных процессов [3], в 20% случаев выявляются остеобластические и смешанные метастазы. Причиной остеобластического типа метастазирования является увеличение остеобластной активности по отношению к уровню резорбции костной ткани остеокластами, что способствует образованию патологической костной ткани. Как остеобластические, так и остеолитические костные метастазы могут вызывать ряд осложнений, таких как костные боли, патологические переломы, компрессионные переломы позвоночника со сдавлением спинного мозга, гиперкальциемию [4]. Такие патологические состояния ухудшают качество жизни и уменьшают ее продолжительность [3-6].
Современный взгляд на процессы костного метастазирования
Метастазирование в кости является многоступенчатым процессом Опухолевые клетки отделяются от первичной опухоли и путем локальной миграции внедряются в кровеносные сосуды. Находясь в кровотоке, они могут адгезироваться на поверхность кости, их взаимодействие с костным микроокружением способствует появлению клеточных циклов с опухолевым ростом и костной деструкцией [2,6]. Опухолевые клетки секретируют факторы, которые стимулируют деструкцию кости посредством воздействия на остеокласты, что способствует появлению более агрессивного опухолевого фенотипа.
Сигнальные пути, факторы транскрипции
Опухолевые клетки и остеоциты могут высвобождаться посредством одних и тех же сигнальных путей и факторов транскрипции, способствующих их взаимодействию в области метастазов. Этот феномен получил название «остеомимикрии» части опухолевых клеток [7]. Например, метастатические клетки РМЖ экспрессируют костный сиалопротеин [8] под контролем Runx2 и MSX2 факторов транскрипции, которые также являются важными факторами регуляции функции остеобластов. Активность Runx2 как в опухолевых клетках, так и в остеобластах, стимулирует продукцию и высвобождение ангиогенных факторов матрикс металлопротеиназ (ММР) в микроокружение кости и надрегуляцию адгезии протеинов, что позволяет опухоли и клеткам кости связываться [9]. Гиперэкспрессия Runx2 опухолевыми клетками может также поддерживать индуцированный опухолью остеокластогенез. Гиперэкспрессия костных сиалопротеинов и секреция факторов транскрипции позволяет сосуществовать этим двум типам клеток и способствует росту метастатических очагов.
Считается, что костное микроокружение играет критическую роль в развитии дефектных циклов, путем изменения фенотипа опухолевых клеток и формирования высоко агрессивных метастатических очагов. Костный матрикс богат различными факторами роста, такими как трансформирующий фактор роста – β (TGF-β), инсулиноподобные факторы роста Iи II(IGF-Iи IGF-II), которые высвобождаются при остеолизисе и могут стимулировать пролиферацию костных и опухолевых клеток. Физические факторы в костном матриксе, включая низкий уровень оксигенации, кислотный pHи высокий внеклеточный уровень концентрации Са2+, обеспечивают создание условий, благоприятных для опухолевого роста. Гипоксия, ацидоз, высокий уровень Са2+, а также факторы роста TGF-β, IGF-Iи IGF-IIспособствуют в комбинации развитию дефектных циклов и появлению костных метастазов.
Как упоминалось выше, при разрушении кости остеокластами высвобождаются Са2+ и факторы роста. Первый рассматриваемый нами фактор роста - TGF-βиграет ведущую роль в развитии остеолитических метастазов. TGF-βприкрепляется к гетеродимерным рецепторам и может активировать Smad-зависимый или Smad-независимый сигнальные пути посредством регулирования сигналов от внеклеточнойсигнал-регулирующей киназы 1/2, р38 митоген-активированной протеинкиназы и c-Jun-NH2терминальной киназы [10]. TGF-βнакапливается в костном матриксе при помощи остеобластов, высвобождается и активируется во время резорбции остеокластов [11]. Он регулирует развитие и ремоделирование костной ткани [12]. При распространенных формах рака часто не происходит блокады процессов роста фактором TGF-β, он является медиатором процессов метастазирования, активизирует инвазию опухолевых клеток, увеличивает уровень ангиогенеза и подавляет иммунное окружение вокруг опухолевых клеток[13].
TGF-βстимулирует рост костных метастазов путем индукции экспрессии протеолитического гена в опухолевых клетках и протеина, высвобождаемого паратиреоидным гормоном (PTHrP), что играет центральную роль. PTHrPэкспрессия наблюдается в клеточных линиях при остеолитическом варианте костного метастазирования рака молочной железы и предстательной железы [14,15]. Повышение его экспрессии характерно для очагов костного метастазирования [16]. Среди факторов, высвобождаемых из кости во время процессов резорбции, только TGF-βувеличивает продукцию PTHrP[14], что происходит через Smad-зависимый и Smad-независимый сигнальные пути [17].
PTHrPне является единственным фактором, регулируемым TGF-β. Циклооксигеназа-2 экспрессируется у 87% пациентов с костными метастазами [18]. TGF-βповышает экспрессию циклооксигеназы-2 в остеобластах, стромальных клетках костного мозга и опухолевых клетках РМЖ, в то время как блокада костной резорбции бисфосфонат резидронатом снижает стабильность циклооксигеназы-2 в кости [18]. Экспрессия циклооксигеназы-2 коррелирует с увеличением продукции интерлейкина-8. Интерлейкин-8 (ИЛ-8) индуцирует активность остеокластов [19] и может также активизировать интерлейкин-11 (ИЛ-11) [20]. ИЛ-11 воздействует на остеокласты посредством RANK (рецептор-активатор ядерного фактора каппа-В) лиганд [21] и путем регуляции ГМ-КСФ (гранулоцитарно-макрофагального колониестимулирующего фактора) [22]. Однако гиперэкспрессия ИЛ-11 не влияет на развитие костных метастазов в отсутствие других прометастатических факторов, таких как остеопонтин, фактора роста соединительной ткани и хемокин-рецептора 4 [23]. ИЛ-11, фактор роста соединительной ткани, хемокин-рецептор 4 и ММР-1 являются надрегуляторами генной структуры РМЖ, они ответственны за формирование остеолитических костных метастазов [23]. Остеопонтин – это белок, секретируемый остеобластами и вовлеченный в минерализацию костного матрикса [24]. Его экспрессия регулируется посредством Runx2 [25], уровень которого в клетках рака молочной железы возрастает при участии TGF-β [26]. Опухолевые клетки, являющиеся источником костных метастазов, часто секретируют протеазы ММР-9 и ММР-13 и катепсин-К [27]. Протеазы вовлечены в процессы костной резорбции [28], а катепсин-К необходим для нормального костного метаболизма.
Другие факторы роста - IGF-Iи IGF-IIявляются наиболее часто встречаемыми и важными протеинами костной ткани [29]. Сигнальные IGFтакже важны для опухоли и ее метастазов, они стимулируют процессы трансформации и ангиогенеза, индуцируют пролиферацию клеток и их инвазию, являясь антиапоптотиками [30].
Физические факторы
Теперь перейдем к рассмотрению физических факторов, способствующих созданию условий, благоприятных для роста костных метастазов. Так, например, гипоксия регулирует продукцию веществ, способствующих пролиферации опухолевых клеток. Солидные опухоли особенно быстро растут в условиях гипоксии, при этом сосуды развиваются по типу патологической васкуляризации, уровень оксигенации клеток не может отвечать метаболическим потребностям растущих тканей, что также способствует поддержанию состояния гипоксии. Кость имеет гипоксичное микроокружение, способное потенцировать рост опухолевых клеток, так как гипоксия регулирует в норме костный гематопоэз и дифференциацию хондроцитов. У человека парциальное давление кислорода (рО2) в костномозговом канале составляет 5% от уровня общего О2 [31]. Опухолевые клетки, способные развиваться в условиях гипоксии, могут расти в гипоксичном костном микроокружении и участвовать в порочном круге костного метастазирования.
Гипоксией индуцированный фактор – 1 (HIF-1) является медиатором гипоксичных сигналов [32]. Этот фактор транскрипции является гетеродимером форм HIF-1αи HIF-1β. Регуляция экспрессии HIF-1α происходит в ответ на уровень оксигенации, в то время как HIF-1βэкспрессируется постоянно. При нормальном уровне оксигенации оксиген-зависимые пролилгидроксилазы преобразуют HIF-1αв специфические остатки. На гидроксилированный HIF-1α воздействует опухолевый супрессор Гиппель-Ландау (von Hippel-Landau) [33]. При низком уровне кислорода не происходит распада HIF-1αпод воздействием пролилгидроксилаз, а образуются гетеродимеры с HIF-1β. HIF-1 гетеродимер внедряется в ядро, где он соединяется с ДНК, являясь медиатором процессов транскрипции генов, контролирующих состояние гипоксии.
Гиперэксипрессия HIF-1αнаблюдается, как правило, при диссеминированных стадиях заболевания [34]. Предполагается, что повышение уровня HIF-1α ассоциируется с более агрессивным, склонным к метастазированию, опухолевым фенотипом. HIF-1αувеличивает уровень транскрипции факторов, ускоряющих патологические циклы развития костного метастазирования. МЕТ является рецептором тирозинкиназы, который связывается с фактором роста гепатоцитов, его гиперэкспрессия при распространенной форме РМЖ ассоциируется с процессами инвазии и метастазирования. Медиатором МЕТ экспрессии выступает HIF-1αв состоянии гипоксии. При совместной гиперэкспрессии HIF-1αи МЕТ в образцах первичной опухоли пациентов с РМЖ, которым выполнена модифицированная радикальная мастэктомия, выявлена корреляция с метастазированием и снижением 10-тилетней безрецидивной выживаемости [35]. HIF-1 также участвует в регуляции процессов экспрессии других факторов, таких как адреномедулин, хемоксин-рецептор 4, фактор роста соединительной ткани, чья роль в канцерогенезе и опухолевом метастазировании доказана [23,36-38].
При нормальном уровне О2, стабилизация HIF-1α регулируется рядом факторов роста, таких как IGF, фактором роста фибробластов, эпидермальным фактором роста (EGF) и фактором-α некроза опухоли. Гиперэкспрессия этих факторов опухолевыми клетками ассоциируется с ускорением пролиферации и распространением опухолевых клеток. Гипоксия и сигнальные пути факторов роста могут взаимодействовать синергично и способствовать развитию патологического цикла костного метастазирования.
В нескольких исследованиях были показаны «перекресты» между гипоксией и сигнальными путями факторов роста. Например, TGF-βусиливает гипоксические сигналы путем селективной блокады пролилгидроксилазы 2 и уменьшает HIF-1α деградацию [39]. Как упоминалось выше, TGF-βявляется важным фактором в развитии остеолитических костных метастазов. Имеющиеся данные указывают на то, что TGF-βпотенцирует сигналы HIF-1 в гипоксичном микроокружении кости.
Как регулятор опухолевой прогрессии и метастазирования, сигнальный путь гипоксии является важной химиотерапевтической мишенью. Блокада этого пути может способствовать предотвращению резистентности к ХТ и ЛТ, медиатором которой является HIF. Сейчас в разработке находятся несколько молекул-ингибиторов сигнального пути гипоксии. Одним из таких ингибиторов является 2-метоксиэстрадиол, один из метаболитов эстрогена и микротубулярный деполимеризирующий агент с антиангиогенными и противоопухолевыми свойствами [40]. 2-метоксиэстрадиол снижает уровень HIF-1αи экспрессию мРНК васкулярного эндотелиального фактора роста (VEGF) in vitroи, таким образом, индуцируется апоптоз опухолевых клеток [41,42]. В Iи IIфазах исследований изучается 2-метоксиэстрадиол в лечении ряда опухолевых заболеваний, планируется исследование его более мощных аналогов, усиливающих антиангиогенный и противоопухолевые эффекты [43]. Другие молекулы антигипоксических препаратов, включая ингибиторы топоизомеразы Iи II, такие как GL331, а также ингибиторы фосфатидилиностинол-3-киназы, такие как LY294002 могут ингибировать генную транскрипцию посредством HIF[44]. Так как метаболический путь HIF-1 перекрещивается со многими сигнальными путями, то блокады только сигнала гипоксии может быть недостаточно для остановки роста и распространения опухоли [45]. Однако эти маленькие молекулярные ингибиторы могут быть эффективны в комбинации с другими препаратами для разрыва порочного круга метастазирования.
Следующим физическим фактором, потенцирующим развитие костного метастазирования, является ацидоз костного микроокружения. Уровень внеклеточного рН в кости имеет большое влияние на функцию остеокластов и остеобластов. В результате внеклеточной ацидификации происходит усиление процессов остеокластной резорбции, при этом максимальная стимуляция остеокластов происходит при уровне рН<6,9 [46]. Процессы минерализации и формирования кости значительно замедляются в кислой среде [47]. Высвобождение щелочных костных минералов из костей влияет как на остеокласты, так и на остеобласты и является компенсаторной реакцией на ацидоз. Опухолевые метастазы в первую очередь локализуются в костях в местах наибольшего ацидоза [46]. Происходит повышение уровня гликолиза и продукции молочной кислоты в результате пролиферации опухолевых клеток и снижения буферной способности интерстициальной жидкости [48]. Имеется гипотеза о том, что индуцированная кислотой опухолевая инвазия меняет метаболизм глюкозы в опухолевых клетках, что способствует стимуляции процессов их пролиферации, в результате чего образуется более инвазивный опухолевый фенотип [49]. Ацидоз изменяет поверхностное клеточное взаимодействие между опухолью и нормальными тканями, индуцируя апоптоз в близлежащих нормальных клетках, и облегчает процессы экстрацеллюлярной деградации матрикса путем высвобождения протеолитических ферментов. В отличие от нормальных клеток, опухолевые клетки имеют компенсаторный механизм, который способствует индукции пролиферации и процессов метастазирования даже при низком уровне внеклеточного рН, они становятся нечувствительны к апоптозу, индуцированному кислой средой.
Гипоксия в дальнейшем вызывает развитие ацидоза в опухолевых клетках опосредованно через HIF-гиперэкспрессию гликолитических энзимов и повышает продукцию молочной кислоты [50]. Гипоксия и рН совместно регулируют механизмы контроля продолжительности жизни и пролиферацию опухолевых клеток.
Опухолевый ацидоз способствует высвобождению и активации протеинов, таких как катепсины В, D, и Lи ММРs, которые снижают степень дифференцировки внеклеточного матрикса и облегчают процессы метастазирования [49]. Катепсин В относится к группе цистеиновых протеаз, экспрессируемых опухолевыми клетками, которые активизируются в кислой среде и могут участвовать в порочном круге костного метастазирования [51]. Следует отметить, что костные метастазы экспрессируют в большом количестве активированный катепсин В. Предполагается, что протеазная активность изменяется при взаимодействии опухолевых клеток и костного микроокружения [52].
Ацидоз, вызванный гипоксией, также активирует некоторые стрессовые сигнальные каскады в опухолевых клетках, включая ядерный фактор-кВ, и активирует патологический сигнальный путь протеина-1, который попеременно регулирует транскрипцию прометастатических факторов, таких как ИЛ-8, цитокинов, важных для подвижности клеток, пролиферации и ангиогенеза [53]. Экспрессия ИЛ-8 индуцируется при помощи длительной гипоксии, при этом снижается внутриклеточный рН в опухолевых клетках [54]. Его гиперэкспрессия коррелирует с уменьшением степени дифференцировки опухоли и увеличением уровня метастазирования при многих злокачественных опухолях, в том числе и РМЖ.
Гипоксия и ацидоз совместно ассоциированы со степенью резистентности раковых клеток к облучению и химиотерапии. Внеклеточная кислотность влияет на резистентность к химиотерапии через рН градиент, что предотвращает внутриклеточную аккумуляцию еженедельно назначаемых препаратов, таких как адриамицин [50]. Опухолевый ацидоз является прямым следствием длительной гипоксии. Таким образом, терапевтические подходы, которые воздействуют на гипоксию, могут способствовать коррекции рН в опухолевых клетках, делая их более восприимчивыми к определенным видам ЛТ и ХТ.
Следующим физическим фактором, воздействующим на процессы костного метастазирования, является кальций, высвобождаемый из костного матрикса. Кальций вовлекается в порочный круг метастазирования при помощи нескольких механизмов. Он является изначально неорганическим компонентом костного матрикса и в костном микроокружении, уровень его поддерживается в узких физиологических границах (1,1-1,3 ммоль/л) [55]. Активная резорбция кости остеокластами вызывает повышение уровня внеклеточного кальция (Са2+) от 8 до 40 нмоль/л [56]. Воздействие Са2+ осуществляется опосредованно через кальциево-специфичные рецепторы (CaSR), G-протеин парные рецепторы, которые в присутствии высокого уровня Са2+ блокируют АМР и активируют фосфолипазу С [57]. CaSRэкспрессируется в нормальных тканях; его гиперэкспрессия отмечена при нескольких типах опухолей, в том числе и РМЖ [58,59]. CaSR регулирует секрецию PTHrP, чья роль в развитии остеолитических костных метастазов обсуждалась раннее [58]. В нормальном эпителии молочной железы CaSRотвечает на низкий уровень Са2+ путем повышения концентрации PTHrP, который активирует костную резорбцию и высвобождает кальций костного матрикса. Продукция PTHrP из этих клеток снижается при высоком уровне Са2+ или агонистов CaSR[60]. В отличие от нормальных маммальных эпителиальных клеток, раковые клетки молочной железы секретируют повышенный уровень PTHrPв ответ на действие известных агонистов CaSR: высокий уровень Са2+, спермина и неомицина [58]. Клинически гиперэкспрессия цитоплазматического CaSRв образцах опухоли молочной железы коррелирует с появлением костных метастазов, также с развитием висцеральных метастазов. Предполагается, что CaSRможет быть хорошим потенциальным маркером, предсказывающим появление костных метастазов [61]. Действие препаратов из групп кальцимиметиков и/или кальцилитиков осуществляется опосредованно через CaSR. Возможно их использование для предотвращения кальциевой активации CaSRи высвобождения PTHrPопухолевыми клетками, что может прервать порочный круг костного метастазирования.
Взаимодействие между опухолевыми клетками и костным микроокружением возникает в результате сочетания множества факторов и сигнальных путей. Костное микроокружение состоит из ряда физических факторов, таких как гипоксия, ацидоз и внеклеточный кальций и факторов роста, таких как TGF-β, которые вовлечены в порочный круг. Эти факторы активируют сигнальные пути в опухолевых клетках, способствуя появлению более агрессивного опухолевого фенотипа. Понимание взаимодействия между опухолью и костью может помочь в определении потенциальной мишени для химиотерапии, для остановки роста опухоли и костного метастазирования.
Бисфосфонаты и их роль в лечении костных метастазов
Бисфосфонаты широко используются в клинике для лечения состояний, связанных с резорбцией костной ткани. Впервые о них заговорили в конце 60-х годов, и с тех пор они успешно применяются в клинике уже более трех десятилетий, однако только недавно мы поняли клеточный и молекулярный механизмы их действия. Большинство бисфосфонатов, используемых в клинике, содержат гидроксильную группу в качестве одной из дополнительных цепей, которая отвечает за сродство к катионам Са2+, что повышает тропность препарата к костной ткани. Вторая дополнительная цепь у бисфосфонатов различается, она отвечает за антирезорбтивный потенциал препарата. Препараты первого поколения характеризовались дополнительными цепями простой химической структуры (клодронат, этидронат). При добавлении одной аминогруппы (памидронат, аледронат) отмечено увеличение антирезорбтивного потенциала по сравнению с этидронатом. Добавление метильной и пентильной групп к аминогруппе аледроната характерно для ибандроната, что еще больше увеличивает антирезорбтивный потенциал препарата. Последнее поколение бисфосфонатов содержит нитрогенную кольцевую структуру, что еще значительнее усиливает его свойства ингибировать костную резорбцию (рисунок 1). На сегодняшний день это поколение бисфосфонатов считается наиболее эффективным (ризедронат, золедронат и минодронат) [62].
Простые бисфосфонаты
Нитроген-содержащие бисфосфонаты.
Рисунок 1. Химическая структура бифосфонатов.
Пероральная биодоступность бисфосфонатов невелика из-за низких липофильных свойств и составляет 1% - 10%. Абсорбция начинается в тонкой кишке через процессы пассивной диффузии, уровень абсорбции уменьшается, когда препарат принимается с едой, напитками (кофе, чай, апельсиновый сок) или в присутствии Са2+ [63]. В качестве альтернативы бисфосфонаты назначают в виде в/в медленной инфузии. Период полувыведения бисфосфонатов составляет 0,5-2 часа.
Высокое сродство бисфосфонатов к костной ткани, богатой Са2+ обеспечивает их абсорбцию и удержание в костях до тех пор, пока не произойдет их высвобождение при помощи процессов остеокластной резорбции. Они могут индуцировать апоптоз остеокластов, что было продемонстрировано в исследованиях in vivoи in vitro[64]. Дополнительно следует отметить, что бисфосфонаты индуцируют ультраструктурные изменения в остеокластах, например, уменьшение или полную потерю гофрированной каймы [65-67]. Этот процесс ассоциируется с разрушением цитоскелета и потерей F-актиновых колец [67,68]. Гофрированная кайма и F-актиновые кольца являются высокоспециализированными структурами в остеокластах, они считаются неотъемлемой частью процесса костной резорбции. Этот феномен был открыт Miller с соавторами много лет назад [66,69]. Лечение бисфосфонатами получило название «парадоксального», оно ассоциируется с увеличением количества и размеров остеокластов [70]. Нитроген-содержащие бисфосфонаты ингибируют внутриклеточный энзим фарнисил-пирофосфат синтазу (FPP) [71-73]. FPPсинтаза является метаболическим ферментом в мевалонатном метаболическом пути. Недавние исследования позволили нам детально понять, как N-бисфосфонаты блокируют ферменты и объяснить различия в степени блокады FPP-синтазы у разных N-бисфосфонатов, используемых в клинике [74,75].
Бисфосфонаты широко используются в лечении пациентов с метастазами в кости. В 12 исследованиях у пациенток с РМЖ и клиническими проявлениями метастатического поражения костей, медиана снижения уровня костных осложнений в группе, где применялись бисфосфонаты по сравнению с группой плацебо составила 29% (разброс 14%-48%) [76]. Основываясь на результатах двух рандомизированных плацебо-контролируемых исследований у пациентов с остеолитическими костными метастазами РМЖ, которым проведено химиогормональное лечение, FDA (Food and Drug Administration - Американский комитет по пищевым продуктам и лекарственным средствам) разрешил внутривенное введение памидроната для предотвращения костных осложнений [77,78]. При этом было получено достоверное увеличение времени до появления первых костных осложнений и снижение общего уровня костных осложнений в промежутке до 2-х лет (таблица 1) [77-80]. В другом плацебо-контролируемом исследовании у пациенток с РМЖ и хотя бы одним остеолитическим очагом золендроновая кислота достоверно снижала риск развития костных осложнений до 39% (р=0,027), снижалось количество пациентов с костными осложнениями за год до 20% (29,8% против 49,6%, р=0,003) [81]. Только в одном исследовании проведено прямое сравнение золендроновой кислоты и памидроната (таблица 1) [82,83]. В этом большом рандомизированном исследовании 3 фазы были продемонстрированы эквивалентные результаты снижения количества костных осложнений при применении золендроновой кислоты и памидроната у пациентов с РМЖ и множественной миеломой. Общее количество костных осложнений было сравнимо в двух группах. Исключение составляла опухолевая гиперкальциемия [83]. Медиана времени до развития первого костного осложнения была схожа у пациентов, получавших золедронат и памидронат, однако у пациентов с РМЖ, получавших гормонотерапию на фоне внутривенного введения золендроновой кислоты 4мг значительно удлинялся промежуток до первого костного осложнения (415 против 370 дней; р=0,047). Эффективность таблетированной и инъекционной формы ибандроната изучалась у пациентов с костными метастазами РМЖ, при сравнении с плацебо обе формы ибандроната (6мг в/в и 50мг р/о) достоверно снижали количество пациентов с костными осложнениями и увеличивали время до появления первого костного осложнения (таблица 1) [86,87]. Однако прямого сравнения золендроновой кислоты и памидроната не проводилось ни с одним из этих препаратов.
По стандартам лечения, принятым на ASCO(Американском обществе клинической онкологии), рекомендовано в/в введение памидроната в дозе 90мг или золендроновой кислоты в дозе 4мг каждые 3-4 недели пациентам с рентгенологическими признаками костной деструкции; данных для предпочтительного использования одного бисфосфоната перед другим недостаточно [88]. National Comprehensive Cancer Network(NCCN) также рекомендовали золендроновую кислоту или памидронат для лечения костных метастазов РМЖ [89]. Однако в рекомендациях NCCNотмечено преимущество золендроновой кислоты перед памидронатом в лечении остеолитических костных метастазов.
Не было достигнуто единого мнения о продолжительности лечения бисфосфонатами. В большинстве исследований пациентов лечили не более 2-х лет. На ASCOпопытались прояснить этот вопрос - для пациентов с метастатической формой РМЖ было рекомендовано продолжать лечение бисфосфонатами до выявления прогрессирования и ухудшения общего самочувствия больного, даже при выявлении костных осложнений [88]. Никаких данных о необходимости прекращения терапии бисфосфонатами после развития костных осложнений не существует.
Лечение бисфосфонатами не влияет на выживаемость больных с диссеминированной формой заболевания [76, 90,92,93], однако при лечении бисфосфонатами в адъювантном режиме в некоторых исследованиях отмечено снижение уровня костного метастазирования и/или значимое увеличение выживаемости, что дало основание предположить, что бисфосфонаты обладают противоопухолевым эффектом [93,45].
По данным некоторых исследований выявлено, что при комбинации бисфосфонатов с цитостатиками может быть получен синергичный эффект. Комбинация золедроната с паклитакселом может вызвать синергичное увеличение уровня апоптоза при раке молочной железы in vitro[95]. При комбинации ибандроната с таксанами выявлен дополнительный эффект предотвращения адгезии опухолевых клеток к костной ткани при РМЖ [96]. Интересно, что в ряде случаев противоопухолевый эффект in vivoзависит от последовательности введения, например, максимальный эффект при назначении доксорубицина достигается через 24 часа после введения золедроната [97], что согласуется с более ранними наблюдениями in vitro[98]. В большинстве случаев механизм лекарственного взаимодействия остается неясен. Однако имеющиеся данные позволяют предположить, что комбинация бисфосфонатов с цитостатиками может способствовать уменьшению количества вводимого бисфосфоната..
Таб. 1. Эффективность бисфосфонатов у пациенток с костными метастазами РМЖ.
Исследование
Препараты
Первичная цель
Результаты
Rosen et al 2001 [82] (n=1643) Rosen et al [83] (n=1648)
Золедронат 4мг или 8мг каждые 3-4 нед. Памидронат 90мг в/в каждые 3-4 нед. (в течение 24 месяцев)
Оценить уровень костных осложнений через 13 мес. и 25 мес.
13 мес: кол-во пациентов с костными осложнениями в 2 группах схожа; кол-во пациентов с ЛТ ниже в группе ЗОЛ. 4мг (15% vs20%,р=0,031) 25 мес: Кол-во пациентов с ЛТ ниже в группе ЗОЛ. 4мг (19%vs24%, р=0,037); ЗОЛ. 4мг снижает риск развития костных осложнений на 16% по сравнению с ПАМ
Rosen et al 2004 [84] (n=1130)
Золедронат 4мг или 8 мг каждые 3-4 нед. Памидронат 90мг каждые 3-4 нед. (12 месяцев)
Оценка костных осложнений через 13 месяцев.
Среди всех пациентов пропорция костных осложнений ≥1 (ЗОЛ 43% vsПАМ 45%); При остеолитич. очагах ЗОЛ 4мг снижает уровень костных осложнений ≥1 (48% vs58%, р=0,058) и достоверно увеличивается время до первого костного осложненя (р=0,013)
Kohno et al 2005 [81] (n=228)
Золедронат 4 мг каждые 4 нед. против плацебо (1 год)
Кол-во костных осложнений.
Кол-во костных осложнений в год 0,63 в группе ЗОЛ и 1,10 – в ПАМ (р=0,016). ЗОЛ уменьшает уровень костных осложнений на 20% (р=0,003) и увеличивает время до первого осложнения (р=0,007)
Carteni et al 2006 [85] (n=312)
Золедронат 4мг каждые 3-4 нед. (12 введений)
Кол-во костных осложнений, время до появления первого, уровень осложнений.
В 30% случаев выявлено ≥1 костного осложнения (в 22% - 1 костное осложнение); Медиана времени до появления первого костного осложнения еще не достигнута; Средний уровень осложнений (до 52 недель) составил 0,9±3,8.
Lipton et al 2000 [80] (n=751)
Памидронат 90мг каждые 3-4 нед. (60-96 недель) против плацебо
Уровень осложнений
Уровень костных осложнений достоверно ниже в группе ПАМ (53% vs68%, р<0,001); ПАМ достоверно увеличивает время до появления костных осложнений (12,7 vs7 мес, р=0,001)
Body et al 2004 (n=564)
Ибандронат 20мг или 50иг р/osежедневно до 96 нед. или плацебо
Уровень костных осложнений
ИБА 50мг достоверно снижает уровень костных осложнений для всех впервые возникших событий.
Body et al 2003 (n=466)
Ибандронат 2мг или 6 мг в/в каждые 3-4 нед. (60-96 нед) или плацебо
Уровень костных осложнений
ИБА 6мг достоверно снижает уровень костных осложнений для всех новых событий (р=0,004); ИБА 6мг достоверно снижает кол-во новых осложнений (р=0,032) и увеличивает время до первого осложнения (р=0,018)
Профиль переносимости бисфосфонатов благоприятный, побочные проявления довольно легкие. Возможно, это связано с их тропностью только к костной ткани, что позволяет им довольно быстро покинуть кровеносную систему. Было отмечено, что токсичность проявляется в случаях введения препаратов в дозах больше тех, которые необходимы для блокады костной резорбции или в том случае, если инфузия препарата осуществляется слишком быстро. Недавно некроз нижней челюсти стал считаться потенциальным осложнением, особенно при длительном назначении бисфосфонатов [99]. Это состояние довольно часто сочетается с плохой гигиеной полости рта, а также может быть вызвано стоматологическими манипуляциями. Этиология этого осложнения еще не изучена. Пациенты с некрозом нижней челюсти, как правило, получают глюкокортикоиды, химиотерапию, что, по всей видимости, создает потенциальный патогенетический механизм.
Внутривенное назначение нитроген-содержащих бисфосфонатов может сопровождаться развитием гриппоподобного синдрома, который рутинно регистрируется у 1/3 больных, получающих нитроген-содержащие бисфосфонаты в первый раз [100,101]. Эти симптомы появляются в результате активации и пролиферации γδ-Т-клеток [101] и высвобождения противовоспалительных цитокинов, таких как TNF-α и IFN-γ [101-103]. Как правило, эта реакция купируется в течение 1-2 дней.
Таким образом, у пациентов с костными метастазами бисфосфонаты стали стандартом лечения для предотвращения или отдаления момента развития костных осложнений. Несмотря на высокую эффективность предотвращения костных осложнений, ассоциированных с онкологическими опухолями, несколько аспектов, связанных с использованием бисфосфонатов остаются нерешенными. Продолжаются исследования:
· направленные на определение оптимальной продолжительности терапии бисфосфонатами,
· изучающие полезность использования костного маркера, предсказывающего ответ на лечение бисфосфонатами,
· освещающие различные аспекты развития токсичности, такие как появление остеонекроза верхней челюсти,
· посвященные вопросу изучения времени начала терапии бисфосфонатами.
Проблема ведения многокомпонентного болевого синдрома
Онкологические костные боли, как правило, возникают при прогрессировании основного заболевания и состоят из фоновой боли и болей, возникающих во время движения. Фоновые боли часто являются первым симптомом метастатического поражения костей, они начинаются в виде тупых постоянных болей, интенсивность которых постепенно увеличивается. Они обычно локализуются в специфических местах и возникают по ночам или в местах наибольшей весовой нагрузки. Фоновые боли могут быть слабыми в покое, усиливаются при движении и в определенных положениях, например, в положении стоя, при ходьбе, сидя или при давлении на область поражения.
Проблема ведения многокомпонентного болевого синдрома подняла вопрос биологического источника болевого синдрома. Резорбция костной ткани, благодаря увеличению остеокластной активности, ведет к уменьшению костной плотности и нарушению костной архитектоники либо в определенном месте, либо в скелете в целом. Плотность миелинезированных и немиелизированных афферентных нервных волокон выше в надкостнице, для нее характерен низкий болевой порог. Микропереломы могут возникать в костных балках, что приводит к костной деформации. Натяжение надкостницы на фоне опухолевого роста, механическое давление на ослабленную кость, ущемление нерва опухолью или напрямую разрушенной костью с последующим коллапсом – это наиболее часто встречающиеся механизмы развития болевого синдрома [104]. Простогландины играют важную роль в появлении остеолитических и остеобластических изменений при метастазах в кости. Высвобождение болевых веществ из поврежденных клеточных мембран, возможно, имеет значение для наблюдения, что боль, вызываемая опухолью часто несоразмерна размеру или степени костного поражения. Экспериментальные модели развития метастатической костной боли прояснили ее этиологию.
К клиническим последствиям костного метастазирования относят понижение нейронного порога и формирование общей гиперчувствительности спинного мозга с усилением ответа на механическую стимуляцию в дополнение к продолжающейся спонтанной активности, ассоциирующейся с плохой чувствительностью к опиоидным анальгетикам. С патофизиологической точки зрения, костные боли, вызываемые движением, соответствуют механической аллодинии (боль, индуцируемая неболевым раздражителем, в данном случае движением), что означает наличие гиперчувствительности, при которой требуются большие дозы опиоидов, чем при базальных болях. Таким образом, механизм костных болей стойко ассоциируется со статусом повышенной возбудимости нейронов, где необходимы более высокие дозы опиоидов.
Мультидисциплинарный подход необходим для лечения костного болевого синдрома. Помимо проведения адекватного обезболивания, химиотерапии, гормонотерапии, введения бисфосфонатов, достаточно широко используется лучевая терапия, которая обеспечивает адекватный симптоматический эффект при локальном болевом синдроме. Имеются данные о том, что ЛТ может иметь более высокий уровень эффективности [105], оптимальные результаты могут быть получены при комбинации ЛТ и бисфосфонатов. Лучевая терапия воздействует на болевой очаг местно, в то время как бисфосфонаты имеют более глобальное профилактическое значение в целом на костные осложнения [106]
Роль лучевой терапии в лечении болевого синдрома, возникшего на фоне костного метастазирования
ЛТ считается наиболее эффективным нехирургическим методом лечения онкологических больных. Её роль при метастатическом поражении костей заключается в использовании наружного облучения и/или введении радиоизотопных препаратов. Основными показаниями к проведению ЛТ при костных метастазах являются: неосложненные костные боли; костные боли неврогенного характера; патологические переломы; компрессия спинного мозга.
Способы оценки эффективности лучевой терапии, качества жизни пациенток
Измерение уровня ответа после ЛТ метастатических костных очагов является предметом для больших дискуссий. В больших рандомизированных исследованиях использовались различные шкалы измерения болевого синдрома и оценки функциональной активности, при этом полученный уровень эффективности был приблизительно одинаковым, сравнения между и даже внутри исследования указывают на вариабельность оценки ответа. Примером могут служить данные датского многоцентрового исследования, сравнивающего два режима фракционирования при облучении метастазов в кости [107].
В результате международная группа по выработке консенсуса опубликовала нормативы оценки болевого синдрома при метастатических костных болях [108]. По этим рекомендациям, боль должна быть оценена по порядковой болевой шкале в пределах от 0 до 10 баллов, где учитывается наибольший и средний болевой синдром в предшествующие 3 дня в месте планируемого облучения. Также необходимо учитывать прием анальгетиков. Частичная ремиссия (ЧР) определяется как уменьшение болевого синдрома на ≥2 балла без увеличения уровня употребления анальгетиков. Стабилизация – это уменьшение употребления анальгетиков ≥ 25%. Полная ремиссия (ПР) – это 0 баллов по болевой шкале с таким же или меньшим количеством принимаемых анальгетиков.
В последующих работах изучалось оптимальное время для определения ответа после паллиативной ЛТ. В проспективном исследовании (n=199) с использованием детальной болевой шкалы в течение первого месяца после лучевой терапии общий эффект (ОЭ) составил 58%, в течение 3-х месяцев - 67% [109]. Однако количество наблюдаемых пациентов за этот период уменьшилось со 134 в 1 месяц до 101 – во второй и 79 – в третий месяц. Таким образом, посчитали, что определение ОЭ должно происходить в первые 2 месяца после окончания ЛТ.
Функциональный статус и качество жизни являются важными целями исследования. В ранних работах эта информация извлекалась из простых коротких опросников [107], в более поздних исследованиях уже использовались большие комплексные функциональные опросники [110]. До недавнего времени стандарт определения качества жизни EORTC QLQ-C30, широко используемый в клинических исследованиях, не имел элемента оценки костной боли. В настоящее время эта ситуация была скорректирована публикацией опросника по оценке качества жизни EORTC QLQ-BM22 для пациентов с костными метастазами, где уже включена оценка интенсивности болевого синдрома, а также функциональная шкала, относящаяся к физическим нарушениям и психологическим аспектам [111]. Возможно, это поможет сформировать стандарт оценки костного болевого синдрома, позволяющего единообразить полученные результаты.
Механизм уменьшения болей после облучения костных метастазов остается неясным. При поверхностном рассмотрении вопроса можно подумать, что это связано с уменьшением опухолевой массы, однако эта версия не подтверждена опубликованными данными. В частности не существует признаков четкой дозозависимости, и нет взаимосвязи между уровнем ответа и известными параметрами радиочувствительности. Известно, что у многих пациентов ответ наступает довольно быстро, за это время размер опухолевой массы не успевает уменьшиться. Следует вспомнить о том, что даже небольшие дозы облучения в 2-4Гр могут способствовать появлению летальных повреждений 50-80% клеточной популяции [112]. Эти клетки больше не высвобождают гуморальные медиаторы боли или другие цитокины, необходимые для активизации остеокластов. Таким образом, важным компонентом влияния облучения на кость, возможно, связано с его воздействием на нормальный костный гомеостаз и, в особенности, на активность остеокластов. Активность остеокластов важна для поддержания дальнейшего развития костных метастазов, а биохимическая блокада остеокластов при помощи бисфосфонатов способствует уменьшению уровня костных осложнений, включая болевой синдром [113].
Рентгенологическая оценка костных метастазов, подвергшихся облучению; осложнения, возникающие на фоне метастатического поражения костей
Одним из неблагоприятных осложнений метастатического поражения костей является появление патологических переломов. В этом случае при наличии возможностей необходимо прибегать к хирургической коррекции. Результаты лечения патологических переломов при проведении лучевой терапии лимитированы. В прошлом имелись противоречивые мнения по этому вопросу с учетом экспериментальных данных, предполагающих, что ЛТ не способствует восстановлению патологического перелома [114]. Однако существуют клинические данные, демонстрирующие признаки реминерализации и рекальцификации после ЛТ при рентгенологическом обследовании, появляющиеся в течение 3-6 месяцев после облучения [115]. По результатам ретроспективного анализа уменьшение болей при наличии патологического перелома после облучения отмечено в 67% случаев, при этом уровень стабилизации болевого синдрома составил 55%, а рекальцификации – 33% [116].
Так Harada с соавт. [117] проведено исследование, изучающее результаты облучения пациентов с метастатическим поражением бедренной кости, которая является частым местом метастазирования. В клинической практике не всем пациентам при наличии угрозы патологического перелома можно выполнить хирургический этап лечения из-за наличия висцеральных метастазов, множественного поражения костей или из-за плохого физикального статуса больного. В этой ситуации при помощи ЛТ можно добиться рекальцификации метастатического очага и уменьшения болевого синдрома. Это исследование, в которое вошли 73 пациента с 84 метастатическими очагами, было выполнено в Онкологическом центре Шизуока (Shizuoka Cancer Center Hospital). У 66 больных отмечено наличие 77 метастатических очагов с болевым синдромом, у 7-ми пациентов болей не было. Проводилась дополнительная системная терапия, включающая в себя ХТ, ГТ и введение бисфосфонатов, медиана наблюдения составила 5 месяцев (1-28 месяцев). Ретроспективно были проанализированы эффективность лечения, появление угрозы перелома и патологические переломы после ЛТ, изменение болевого синдрома и выживаемость этих больных.
В этом исследовании были использованы критерии оценки, представленные в таблице 2, они основываются на наличии признаков рекальцификации, на структурных начальных изменениях на рентгенограммах, указывающих на процессы костного ремоделирования. Система рентгенологических критериев ответа Mirels с соавторами [118] использовалась для оценки состояния угрожающих патологических переломов (таблица 3). По этой системе, оценка в 8-9 баллов ставится при наличии угрозы патологического перелома. Среди 84 оцененных очагов, в 43 случаях была поставлена оценка ≥ 8 баллов, что было расценено как угрожающий патологический перелом.
Таб. 2. Рентгенологические критерии ответа [117]
Уровень ответа
Остеобластические очаги
Смешанные очаги
Остеолитические очаги
Рентгенонегативные очаги
Полная регрессия
Полное закрытие очага нормальными тканями
Полное закрытие очага нормальными тканями
Полное закрытие очага нормальными тканями
Полный склероз очага
Частичная регрессия
Уменьшение размеров, частичное закрытие очага нормальными тканями
Склеротический ободок, частичное закрытие очага нормальными тканями
Склеротический ободок, частичное закрытие очага нормальными тканями
Склеротический ободок
Стабилизация
Без изменений размеров
Без изменений размеров
Без изменений размеров
Без изменений размеров
Прогрессирование
Увеличение размеров очага
Увеличение размеров очага
Увеличение размеров очага
Появление литического очага
Таб. 3.Бальная система оценки угрожающего патологического перелома [118]
Параметры оценки
Баллы
1
2
3
Место поражения
------------
Диафиз/дистальная часть бедренной кости
Проксимальная часть бедренной кости
Болевой синдром
Легкой степени
Средней степени
Тяжелой степени
Очаги
Бластические
Смешанные
Литические
Размеры
<1/3
>1/3, <2/3
>2/3
В этом исследовании уровень ПР составил 10%, ЧР -32%, ОЭ – 42%, стабилизация зафиксирована в 35%, прогрессирование – в 23% случаев. При наличии угрозы патологического перелома (43 очага) в 15 случаях был отмечен рентгенологический ответ. Через 3, 6 и 12 месяцев после окончания ЛТ 49 пациентов с 57 очагами, 32 пациента с 38 очагами и 15 пациентов с 18 очагами были живы. Уровень рентгенологического ответа у этих больных составил 30%, 45% и 50%соответственно. Медиана интервала от начала ЛТ и до появления максимального рентгенологического ответа (ПР + ЧР) составила 3 месяца (1-13 месяцев). Проведение системной терапии, введение бисфосфонатов и вид первичной опухоли достоверно коррелируют с лучшим рентгенологическим ответом.
Из 35(42%) случаев рентгенологического ответа на облучение (ПР + ЧР) у 30-ти больных местного прогрессирования не выявлено до смерти или до последнего визита, медиана периода наблюдения составила 10 месяцев (2-28 месяцев).
В 11-ти случаях (13%) необходимо было проведение хирургического вмешательства, у 8-ми пациентов были выявлены патологические переломы, у 7-ми из них существовала угроза патологического перелома до начала облучения.
У 66 больных отмечено наличие 77 метастатических очагов с болевым синдромом, в 47% случаев было отмечено уменьшение болевого синдрома, в 47% - стабилизация, в 6% - прогрессирование. Общая медиана выживаемости составила 7 месяцев (95% КИ равен 4-9 месяцев), 6-ти и 12-ти месячная выживаемость составила 52% и 38%, соответственно.
В этом исследовании были получены интересные наблюдения, касающиеся рентгенологического ответа на лечение в присутствии бисфосфонатов: в 19 из 35 случаев общего эффекта они назначались до или после облучения. Недавно были опубликованы данные преклинических исследований, показывающих, что бисфосфонаты обладают противоопухолевой активностью in vivoи in vitro[119]. Данные этого исследования также подтверждают эффективность бисфосфонатов в лечении пациентов с костными метастазами.
Обобщая полученные результаты этого исследования, можно сделать вывод о том, что метастатические очаги с высоким риском развития перелома необходимо подвергать хирургической коррекции, а метастатические очаги без риска патологического перелома могут быть подвергнуты ЛТ с или без системной терапии. В подгруппе пациентов без наличия угрозы патологического перелома неудача в лечении наблюдается в 7% (3 из 41) случаев. Таким образом, большинство пациентов без угрозы патологического перелома могут успешно проходить облучение и должны лечиться таким образом.
В исследовании Harada с соавт. пациенты с плохим физикальным статусом были облучены при наличии угрозы патологического перелома. Было выявлено, что 35% очагов с угрозой перелома ответили на ЛТ и только в 19% случаев (8очагов) потребовалось хирургическое вмешательство. Следовательно, риск возникновения патологического перелома может быть снижен также при помощи ЛТ. Правильно подобранная ЛТ может быть альтернативным методом хирургическому лечению в этой ситуации. С другой стороны, в очагах с угрозой патологического перелома при наличии рентгенологических признаков прогрессирования, повышается риск развития патологического перелома до 46% (6 из 13). Если общее состояние пациента позволяет провести хирургическое вмешательство, то им должна быть проведена профилактическая внутренняя фиксация.
В предыдущих публикациях отмечено, что рентгенологическая рекальцификация не коррелирует с уменьшением болевого синдрома [120]. Также не было выявлено корреляции между рентгенологическим ответом и уменьшением болевого синдрома. Следовательно, важно оценивать рентгенологический и клинический ответы независимо друг от друга.
Облучение не может полностью излечить кость и избежать хирургического вмешательства при метастатическом поражении бедренной кости и появлении угрозы патологического перелома в течение всей продолжительности жизни. Промежуточный рентгенологический контроль необходим для своевременного и адекватного реагирования.
Другим неблагоприятным осложнением костного метастазирования является метастатическая компрессия спинного мозга. Основным методом оценки эффективности лечения данного состояния является функциональный статус больного. Однако его оценка в разных исследованиях варьирует, начиная от простого измерения статуса передвижения и заканчивая комплексными многофакторными признаками, такими как функциональная шкала Франкеля или шкала Functional Living Index-Cancer(FLIC) [121]. Оценка боли является также важной конечной целью лечения метастатической компрессии спинного мозга, однако в литературе сложно встретить систематизированные данные.
Обычно пациенты с начальными симптомами поражения после лечения возвращают свой функциональный статус, 80-90% больных улучшают или стабилизируют его, в том случае, если правильный диагноз был поставлен на этапе параплегии, то шансы восстановить функциональный статус после облучения падают до 25-30% [122]. Данные по контролю болевого синдрома при компрессии спинного мозга аналогичны таковым при облучении неосложненного болевого синдрома, при этом уровень уменьшения боли колеблется в пределах 60-80%. Проспективных рандомизированных исследований в этой области немного, в одном из них проведено сравнение только ЛТ с комбинированным лечением: операция + ЛТ [123]. В обеих группах было проведено идентичное облучение СОД – 30Гр за 10 ежедневных фракций. В исследование включено 123 пациента за 10-тилетний период с учетом следующих критериев: параплегия длительностью менее 48 часов; компрессия спинного мозга в одной анатомической области при хорошем физикальном статусе пациента. Уровень функциональной активности в хирургической группе после лечения составил 84%, при проведении только ЛТ – 57%, медиана длительности эффекта составила 153 дня и 54 дня, медиана выживаемости – 126 дней и 100 дней, соответственно. Таким образом, в этом небольшом исследовании было продемонстрировано преимущество хирургического метода у избранной группы пациентов, предполагается, что облучение необходимо проводить больным, у которых выявлено множественное метастатическое поражение костей, при неудовлетворительном общем статусе, при наличии других значимых осложнений, в том случае если нет возможности технически осуществить хирургическое вмешательство.
Были определены важные факторы неблагоприятного прогноза ответа на ЛТ при наличии признаков компрессии спинного мозга. Они включают в себя наличие висцеральных метастазов, ухудшающих общий статус пациента, быстрое нарастание функционального дефицита до начала лечения и ухудшение моторной функции после ЛТ [124]. Наилучшие результаты продемонстрированы у пациентов, имеющих более длительный период развития клинической симптоматики до появления параплегии и тех, у кого заболевание ограничено наличием первичного очага и только метастатическим поражением костей.
Дозы и режимы фракционирования лучевой терапии
Существует несколько способов подведения дозы к метастатическим очагам в костях, одним из которых является стандартное фракционирование, когда суммарная очаговая доза (СОД) 30-50Гр подводится разовыми очаговыми дозами (РОД) 2 Гр, ежедневно, пять раз в неделю. Но наряду с этим достаточно широко применяются и короткие курсы облучения с применением РОД 3-4-5-6,5 Гр и СОД 19,5 – 30Гр, а также однофракционное облучение 8-10Гр [125-139].
Одними из первых в России облучение крупными фракциями по 6,5 или 8,5Гр с интервалом 48 часов при костных метастазах применили Нивинская М.М. с соавторами в 1974 году у 53 больных, в том числе у 25 с РМЖ. В 62 случаях проведена дистанционная гамма терапия РОД 8,5Гр (СОД 17Гр) за 2 фракции, в 9 случаях – РОД 6,5Гр (СОД 13Гр) за 2 фракции. Из 53 больных на 3-5 дни после облучения боли полностью исчезли у 15 (28,3%) пациентов, значительно уменьшились у 30 (56,6%), остались без изменения у 6 (11,3%). Авторы предложили чаще применять облучение крупными фракциями как эффективный и высокоэкономичный метод паллиативного воздействия. Его преимущество перед стандартным облучением заключалось в быстрой реализации терапевтического эффекта у тяжелых больных, нередко трудно транспортируемых и плохо переносящих длительный курс облучения [126].
Куталадзе Т.О. подтверждена высокая эффективность облучения крупными фракциями у 131 больной с множественными метастазами в кости РМЖ – 95,9%. Объективный эффект наблюдался у 11,1% пациенток, субъективный – у 84,9% [140].
Волкова М.А. с соавторами сравнили эффективность двух режимов фракционирования дозы при облучении костных метастазов РМЖ: классическое – 2Гр
( СОД 40-50Гр), проведенное у 47 (29,1%) пациенток, и крупнофракционное – 4Гр (СОД 20-24Гр) – у 115 (70,9%) больных. При лечении крупными фракциями в объем облучения вошли не только рентгенологически выявленные метастазы, но и кости данной анатомической области (соответствующая половина таза, отдел позвоночника и пр.). Преимущество укрупненного фракционирования по сравнению со стандартным заключалось в значительном сокращении длительности курса с 4-5 недель до 5-6 дней, более раннем исчезновении болевого синдрома – у 45,3% и 14,9% больных, увеличение продолжительности жизни 2 года и более – у 18,2% и 6,3% больных, соответственно. Общие лучевые реакции в виде слабости, потери аппетита и головокружения наблюдались в 20% случаев – при крупнофракционном и 40% - при стандартном облучении, явления энтерита – в 21,6% и 29,7%, стойкая лейкопения – в 6,9% и 25,6% случаев соответственно. Выявленные симптомы самостоятельно купировались и почти не требовали специального лечения [141].
В исследование Хмелевского Е.В. вошли 333 пациента с метастазами в кости (в 73% случаев имели место метастазы рака молочной железы), которым было проведено лечение в виде 448 курсов облучения с использованием следующих режимов фракционирования (таблица 4): 6,5Гр/4 фракции, 6,5Гр/3 фракции, 6,5Гр/2 фракции, 2Гр/23 фракции. Общая эффективность лечения составила 96,6% (ПР 65,9%), 95,8% (50,4%), 100% (33,3%), 100% (78,4%), соответственно.
Таб. 4. Эффективность лучевой терапии метастазов в скелет в зависимости от дозы и режима облучения
Режим ЛТ
Эффективность лечения
Рецидив боли (%)
ОЭ (%)
ПР (%)
6,5Гр х 4фракции (СОД 26Гр)
96,6
65,9*
7,4
6,5Гр х 3 фракции (СОД 19,5Гр)
95,8
50,4*
10,9
6,5Гр х 2 фракции (СОД 13Гр)
100
33,3*
8,3
2Гр х 23 фракции
100
78,4*
7,8
Достоверность
*р<0,03
Получены достоверные различия в частоте полного эффекта в зависимости от варианта ЛТ (р<0,03), поздние лучевые изменения (фиброзы мягких тканей 2-3 степени) достоверно часто встречались после 6,5Гр/ 4 фракции и 2Гр/23 фракции режимов облучения 31,1% и 26,3%, что достоверно выше, чем при режиме облучения 6,5Гр/3 фракции 7,1% (р=0,04)[142].
Имеется большое количество зарубежных исследований, сравнивающих различные дозы облучения при лечении метастатических костных болей. Было показано, что однофракционные курсы облучения также эффективны как и многофракционное облучение, что было подтверждено результатами 5-ти мета-анализов [143,144-147]. В таблице 5 представлены данные 16-ти исследований с 1986 года по 5000 пациентам [143]. Всего 2513 больных были рандомизированы для лечения в группу однофракционного облучения и 2487 – в группу многофракционной ЛТ. Уровень ОЭ при оценке болевого синдрома был сравним и составил в группе однофракционного облучения 58%, в группе многофракционного облучения – 59%. Индивидуальный уровень вероятности колебался между 0,84 и 1,08. При проведении общего анализа уровня вероятности не выявлено различий в ОЭ болевого синдрома при проведении однофракционного и многофракционного облучения.
В 9-ти исследованиях описаны результаты повторной лучевой терапии у 4085 пациентов. Больший уровень повторных облучений был представлен в группе однофракционного облучения – 20% из 2053 случаев по сравнению с 8% из 2032 случаев в группе многофракционного облучения (р<0,0001). Вероятность повторного облучения выше в 2,5 раза в группе однофракционной ЛТ (95% КИ, 1,76-3,56).
В 8-ми исследованиях представлены данные по уровню патологических переломов. Больший уровень патологических переломов был выявлен при проведении однофракционного облучения – 3,2% из 2018 случаев по сравнению с 2,8% на 1004 случаев многофракционной ЛТ, статистически значимых различий не получено (р=0,75).
Таким образом, уровень риска развития патологического перелома достоверно не различается в двух группах.
Также были рассмотрены данные по острой токсичности. Достоверных различий между двумя группами не получено. Однако в двух исследованиях отмечен более благоприятный профиль токсичности однофракционного облучения. В исследовании Harstell с соавт. [158] выявлен больший уровень острой токсичности (2-4 степень) при многофракционном облучении (р=0,2), а Kaas с соавт. [161] было показано, что у чуть большего числа пациентов при однофракционном облучении отмечена тошнота и диарея.
Таб. 5.Исследования по паллиативному облучению метастазов в кости [143]
Характеристика исследований
Кол-во пациентов
Авторы
Годы
Лечебные группы
Кол-во пациентов, вошедших в анализ
Рандомизированных
Оцененных
Price et al [148]
1986
8Гр и 30Гр/10фр
288
288 пациентов/очагов
97
Cole [149]
1989
8Гр и 24Гр/6фр
29
29 пациентов/очагов
25
Kagel et al [150]
1990
8,10,12,15Гр и 20Гр/4фр или 25Гр/5фр или 22,5Гр/5фр
27
27 пациентов/очагов
27
Gaze et al [110]
1997
10Гр и 22,5Гр/5фр
260
280 рандомизированных
240 очагов
Foro et al [151]
1998
8Гр и 15Гр/3фр или 30Гр/10фр
75
75 пациентов/очагов
75
Nielsen et al [107]
1998
8Гр и 20Гр/5фр
241
241 пациентов/очагов
207
Bone Pain Trial Working Party [152]
1999
8гр и 20Гр/5фр
765
765 пациентов/очагов
681
Koswig and Budach [153]
1999
8Гр и 30гр/10фр
107
107 пациентов
107
Steenland et al [147]
1999
8Гр и 24Гр/6фр
1171
1171 пациентов
1157
Kirbride et al [154]
2000
8Гр и 20гр/5фр
398
398 пациентов
278
Ozsaran et al [155]
2001
8гр и 20Гр/5фр или 30Гр/10фр
87
109 очагов
109
Sarkar et al [138]
2002
8Гр и 30Гр/10фр
73
73 пациента
36
Altundag et al [156]
2002
5 или 8Гр и 30гр/10фр
54
60 очагов
49
Badzio et al [157]
2003
8гр и 20гр/5фр
115
146 очагов
126
Van der Linden et al [158]
2004
8Гр и 24Гр/6фр
1157
1157 пациентов
1099
Harstell et al [159]
2005
8гр и 30Гр/10фр
898
898 пациентов/очагов
573
Roos et al [160]
2005
8Гр и 20гр/5фр
272
272 пациентов/очагов
234
Kaasa et al [161]
2006
8Гр и 30гр/10фр
376
376 пациентов/очагов
307
Haddad et al [162]
2006
8Гр и 30Гр/10фр
70
70 пациентов
58
В мета - анализах, сравнивающих однофракционное и многофракционное паллиативное облучение с целью купирования болевого синдрома, возникающего при метастатическом поражении костей, достоверных различий между двумя группами не получено [163,146]. При добавлении данных 7-ми недавно законченных исследований результаты мета- анализа были дополнены и доработаны. Заключение по поводу отсутствия статистических различий в уровне ПР и ЧР осталось неизмененным. В группе однофракционного облучения отмечен достоверно больший уровень повторных облучений. Имеется тенденция к большей частоте патологических переломов и метастатической компрессии спинного мозга при проведении однофракционного облучения, однако эти данные не являлись первичной целью исследования, и дополнительный анализ не показал статистических различий.
Рандомизированные исследования, включенные в этот мета – анализ, подверглись критике из-за плохого качества в обзоре Shakespeareи др., где оценивались данные 8 из 18-ти включенных в анализ исследований[164]. Плохо продуманный дизайн и качество могут сказаться на достоверности результатов [165]. Glastein и соавт.[166] отметили, что результаты этих исследований могут повлиять на общее заключение, сделанное в мета – анализе.
Несмотря на плохое качество клинических исследований и наличие различий в целях, имеется большая уверенность в том, что однофракционное лечение эквивалентно многофракционному облучению в купировании болевого синдрома у пациентов с неосложненными костными метастазами. Однако существует риск повторного облучения при однофракционной ЛТ, уровень которого довольно велик. Однофракционное облучение подходит для пациентов, у которых ожидаемая продолжительность жизни коротка.
Van der Hout идр. [167] представили экономический анализ, сравнивающий эти режимы облучения. С экономической точки зрения выгодно проведение однофракционного облучения [167], что важно для стран с ограниченными финансовыми возможностями.
Однако для определенной группы пациентов, необходимо проведение пролонгированных курсов облучения. Roos с соавт. [160] сравнивали однофракционное облучение (8Гр) и 20Гр/5фр у пациентов с костными метастазами, вызванными болями с неврогенным компонентом. Они пришли к выводу, что однофракционное облучение не так эффективно как многофракционное для лечения неврогенных костных болей. Они рекомендовали использовать облучение в режиме 20Гр/5фр у данной категории больных. Однако у пациентов с небольшой ожидаемой продолжительностью жизни, плохим физикальным статусом можно использовать однофракционное облучение, как один из вариантов лечения [160].
При наличии признаков метастатической компрессии спинного мозга режимы фракционирования могут быть различны, начиная с однофракционного режима СОД 8-10Гр и заканчивая многофракционными режимами СОД 40Гр/20фр [168]. На сегодняшний день оптимальный режим ЛТ при метастатической компрессии спинного мозга не определен. Недавно были опубликованы UK NICE(National Collaborating Centre for Cancer2008) директивы, где было сделано заключение о том, что в настоящий момент ЛТ может проводиться как в режиме одной фракции, так и в режиме последовательного лечения множественными фракциями. Таким образом, сейчас чаще всего используются 5-10 фракционные режимы облучения для послеоперационных пациентов и больных с благоприятным прогнозом.
Koswigи Budach[153] изучали уменьшение болевого синдрома и реминерализацию при однофракционном 8Гр и многофракционном 30Гр/10 фракций режимах облучения. Достоверных различий в уменьшении болевого синдрома в двух группах не получено, при многофракционном облучении отмечен больший уровень реминерализации. Через 6 месяцев после облучения в группе многофракционной ЛТ среднее увеличение костной плотности составило 173% по сравнению с 120% в группе однофракционного облучения (р=0,0001). Основной целью облучения пациентов с хорошим прогнозом, особенно с солитарными костными метастазами и хорошим физикальным статусом, является увеличение реминерализации и получение стабилизации, а не только паллиативное лечение [153]. Авторы подчеркнули, что пациенты с раком молочной железы, являются группой с ожидаемой большой продолжительностью жизни и тенденцией к появлению солитарных метастазов, что требует проведения многофракционного облучения в клинической практике [153].
Данные этого системного обзора позволили отметить наличие эквивалентности уменьшения болевого синдрома в группах однофракционного и многофракционного режимов облучения. Проблемой является определить, кто из пациентов нуждается в многофракционном облучении. Радиологические отделения должны критически оценить каждого пациента с целью максимизации эффекта от использования имеющихся радиологических ресурсов.
Потенцирующий эффект комбинации ЛТ и системного введения бисфосфонатов
Имеются лимитированные данные о том, что комбинация ЛТ с системным введением бисфосфонатов усиливает процесс рекальцификации, способствуя восстановлению костной ткани после повреждения в результате метастатического процесса, что, соответственно, может повлиять на уменьшение клинических проявлений костных метастазов [169]. В исследовании, проведенном Vassilou V. с соавт., нитроген-содержащий бисфосфонат ибандронат назначался на фоне облучения. Авторам было интересно выявить, насколько их комбинированное использование может иметь синергичное влияние на костные боли и процессы костного ремоделирования [169]. Пациентам назначался в/в ибандронат 6мг и проводилось многофракционное облучение. Через 3 месяца лечения было отмечено значимое уменьшение болевого синдрома. ПР болей выявлена у 70% пациентов, к концу периода наблюдения эта цифра возросла до 80%. Снижение болевого синдрома ассоциировалось с увеличением функциональной активности пациентов и улучшением общего самочувствия. Небольшому количеству пациентов потребовалось оставить опиоиды с анальгезирующей целью (84% - до начала лечения и 24% через 3 месяца наблюдения), но дозы их были снижены. Баллы физической активности увеличились в 2 раза, что было расценено как значимое изменение. Оценка метастатических костных очагов производилась при помощи КТ или МРТ. Однако в исследовании не было контрольной группы, результаты, полученные здесь, позволяют сделать вывод только о том, что комбинация ибандроната и ЛТ эффективна для уменьшения болевого синдрома.
Следует отметить, что результаты применения только лучевой терапии при метастатическом поражении костей различны. Так в исследовании, выполненном Radiation Therapy Oncology Group(RTOG) в 1982 году ПР болевого синдрома отмечена у 54% пациентов с медианой длительности эффекта 12 месяцев, ОЭ зарегистрирована у 90% больных [170]. В рандомизированном исследовании, выполненном Hartsell с соавт. [159] недавно, проводилась оценка однофракционного и многофракционного режимов облучения, было получено сравнимое уменьшение болевого синдрома. Уровень ПР боли составил около 18% через 3 месяца, ЧР – приблизительно 48%; 32% больных продолжали принимать опиоиды.
Большая общая эффективность, полученная в исследовании Vassilou V. с соавт. по сравнению с исследованием Hartsell, возможно, частично связана с использованием комбинированного лечения (ибандронат + ЛТ), с наличием меньшего уровня болевого синдрома на момент включения в исследование.
Различные бисфосфонаты продемонстрировали свою эффективность при лечении болевого синдрома, однако, в первую очередь внимание было обращено на ибандронат, так как данные по его эффективности указывают на значительное снижение болевого синдрома до 2-х лет, что было отмечено в исследованиях IIIфазы [171-173]. Максимальный ответ наблюдается в течение первых 3-х месяцев.
Таким образом, эффективность комбинации ибандроната с облучением не хуже, а в некоторых случаях даже лучше при сравнении с результатами других исследований. Например, во IIфазу исследования было набрано 52 пациента с различными солидными опухолями, получившим нестандартную дозу ибандроната 4мг, либо в виде одного введения, либо каждые 4 недели в сочетании с облучением 36-40Гр [174]. Это лечение потом подкреплялось ежемесячным в/в введением ибандроната 3мг. Используемые дозы ибандроната в этом исследовании не были оптимальными, однако комбинированное лечение позволило достичь достоверного снижения болевого синдрома, уменьшения использования анальгетиков, увеличения уровня кальцификации метастатических очагов. Имеются данные по изучению эффективности комбинации ЛТ с памидронатом, представленные Kouloulias и др. [175-177]. В этой работе пациенты с различными солидными опухолями получали ежемесячно памидронат 180мг на фоне облучения СОД 30Гр. Комбинированное лечение ассоциировалось с увеличением уровня рекальцификации в области метастатического поражения кости по сравнению с только ЛТ [174-177]. Следует заметить, что болевой синдром уменьшился значительно через 6 месяцев после лечения на 5,8 пунктов при использовании двухкомпонентной 10-тибальной шкалы, а также выявлено значительное улучшение качества жизни и общего статуса пациента [177]. Таким образом, уменьшение болевого синдрома, полученное при комбинации памидроната и ЛТ сравнимо с результатами, полученными в предыдущем исследовании, однако доза памидроната в 180мг в два раза больше разрешенной, что не дает возможности использовать результаты этого исследования в общей практике. Также следует отметить, что у приблизительно 39% пациентов, при лечении памидронатом, выявляется острая токсичность (гриппоподобный синдром и лихорадка) при сравнении с 7% токсичности, полученными в исследовании Kouloulias и др.
Мы можем сделать вывод о том, что уровень паллиативного эффекта у разных бисфосфонатов не одинаков, что предполагает наличие различий в эффективности комбинированной терапии (бисфосфонаты и ЛТ). Этот вопрос требует дальнейшего изучения.
Еще одним аспектом, на который следует обратить внимание, является достоверное уменьшение количества принимаемых опиоидных анальгетиков при проведении комбинированной терапии. Возможность снижения токсичности, связанной с приемом опиоидов, может считаться дополнительным успехом комбинированного лечения.
Метастатическое поражение костей при раке молочной железы по данным высокопольной магнитно-резонансной томографии
Сергеев Н.И., Котляров П.М., Солодкий В.А., Близнюков О. П.
ФГБУ «Российский научный центр рентгенорадиологии» Минздравсоцразвития РФ, г.Москва.
Введение
Рак молочной железы одно из самых распространенных злокачественных новообразований у женщин. Заболеваемость РМЖ увеличивается с возрастом (как правило, опухоли возникают после 35-40 лет, пик заболеваемости регистрируют у женщин в возрасте 60-65 лет). Во всех странах мира за последнее десятилетие возросли заболеваемость и смертность женщин от РМЖ. Самые высокие стандартизированные показатели заболеваемости РМЖ зарегистрированы в США, где РМЖ составляет 32% всех впервые диагностированных случаев рака у женщин. Риск развития инвазивного рака в течение жизни составляет 12,6% (у каждой восьмой женщины). В России в структуре заболеваемости злокачественными новообразованиями РМЖ занимает первое место. В 2006г распространенность РМЖ среди пациентов со злокачественными опухолями в России составила 17,8%. Контингент больных РМЖ на 100 000 населения составляет 305,9, всего в России 437 774. Абсолютное число заболевших в 2006г – 48 821, при этом процент прироста за 10 лет (с 1997г. по 2006г.) составил 24.6% [1].
Метастатическое поражение костей одно из наиболее частых осложнений рака молочной железы. По данным ряда авторов рак молочной железы метастазирует в кости в 45-80% случаев. Столь большой диапазон обусловлен различными морфологическими формами рака, длительностью течения, а также сроками начала лечения.
Наиболее часто поражаются поясничные (59%) и грудные (57%) отделы позвоночника, кости таза (49%) и рёбра (30%), т. е. в основном вовлекаются в процесс кости осевого скелета. Примерно у 15% больных костные метастазы являются единственным проявлением заболевания. Предрасположенность некоторых опухолей (молочной и предстательной желез) метастазировать в кости осевого скелета объясняется наличием венозно-вертебрального сплетения, куда поступает кровь из молочной железы и полости таза. Это сплетение характеризуется отсутствием клапанов, базальных мембран в сосудах костного мозга, низким внутрисосудистым давлением, что создает благоприятные условия для экстравазации опухолевых клеток [2]. Костная ткань в человеческом организме находится в динамическом равновесии чередования резорбции и костеобразования, данное состояние поддерживается за счет клеток, разрушающих костную ткань (остеокласты) и клеток, создающих ее (остеобласты). Регуляция этого процесса происходит за счет воздействия эндокринной системы (паращитовидные железы). В соответствии с этим, выделяют три типа костных метастазов: остеобластические (склеротические), остеокластические (литические) и смешанная форма. Наиболее характерный тип метастазов при РМЖ – остеолитические, однако, довольно часто встречаются и смешанные формы.
Распространение метастазов происходит гематогенным путем. Раковая клетка попадает в малый круг кровообращения через венозно-вертебральные сплетения. Попавшая в капилляры костного мозга клетка легко мигрирует в кость в связи с отсутствием базальной мембраны в этих капиллярах и низкой скорости кровотока в этой области. При дальнейшем развитии метастатического эмбола происходит экспрессия паракринных факторов, среди которых особое значение имеет паратиреоидподобный гормон (ПТПГ), стимулирующий резорбцию кости. Резорбция кости происходит не прямо, а опосредованно. Рецепторы к ПТПГ находятся на остеобластах, которые, в свою очередь, посредством выделения интерлейкинов, колониестимулирующего фактора макрофагов и прочих факторов активизируют остеокласты и клетки-предшественники.
ПТПГ был открыт в результате поиска факторов, секретируемых опухолевыми клетками в кровь, и являющихся причиной наиболее частого метаболического нарушения при онкологических заболеваниях — гиперкальциемии. В настоящее время исследуется роль ПТПГ в развитии гиперкальциемии как причинного фактора метастазирования (в частности, в кости) в развитии остеолиза при метастазах. К настоящему времени ПТПГ выделен из клеток РМЖ, рака мочевого пузыря, плоскоклеточного рака легкого, рака почки, то есть опухолей, наиболее часто осложняющихся развитием гиперкальциемии. Клетки РМЖ секретируют ПТПГ в 50—60% случаев. При системном введении ПТПГ воспроизводилось большинство эффектов гиперкальциемии и первичного гиперпаратиреоидизма — повышение содержания кальция, фосфатурия, повышение экскреции циклического АМФ, повышение канальцевой реабсорбции кальция, усиление активности остеокластов и повышение продукции витамина D. В то же время ряд исследований показал, что введение антител к ПТПГ не полностью нивелировало гиперкальциемию, что указывало на участие в патогенезе других механизмов [3-11].
Таким образом, имеются убедительные доказательства того, что клетки РМЖ продуцируют факторы, активизирующие остеокласты, которые вызывают резорбцию костной ткани; при этом выделяются цитокины и факторы роста, которые, в свою очередь, стимулируют пролиферацию опухолевых клеток. При этом образуется «порочный круг».
Цель исследования: Оценка возможностей высокопольной магнитно-резонансной томографии в выявлении вторичного поражения тел позвонков, костей таза при раке молочной железы.
В рамках поставленной цели решались следующие задачи.
1. Оценить возможность и эффективность высокопольной МРТ в диагностике вторичного поражения позвоночника, костей таза при РМЖ.
2.Выявить характерные для различных морфологических типов рака молочной железы признаки вторичного поражения позвоночника, костей таза по данным МРТ.
Материалы и методы
В ФГУ «Российский научный центр Рентгенорадиологии» были обследованы 68 пациентов с верифицированным диагнозом рак молочной железы. При этом гистологические типы опухолей составляли: инфильтрирующий протоковый рак – 44 (64%), инфильтрирующий дольковый рак – 22 (33%), инфильтрирующий протоковый рак с преобладанием внутрипротокового компонента 2 (3%). Показаниями для проведения магниторезонансной томографии являлись данные рентгенографии, остеосцинтиграфии, а также наличие клинической картины. Наиболее частыми жалобами (симптомами) были боль в области метастатического поражения в проекции того или иного отдела позвоночника, в тазовых костях, в 35% случаев отмечались сочетанные локализации.
Магнитно-резонансная томография выполнялась на высокопольном томографе «Signa» с напряженностью магнитного поля 1.5 тесла. Сканирование выполнялось в положении больного лежа на спине по стандартной программе с получением Т1, Т2 взвешенных изображений в последовательностях FSEв аксиальной, сагиттальной, фронтальной проекциях, толщиной среза и межсрезовым промежутком 5 мм. Исследование обязательно дополнялось программой с подавлением сигнала от жировой ткани (FatSat). В ряде случаев для уточнения диагноза, оценки локальной распространенности процесса и получения другой дополнительной диагностической информации пациентке внутривенно вводились высокие дозы парамагнетика (40-60 мл).
Анализ материала и обсуждение результатов исследования
Анализ данных магнитно-резонансной томографии показал, что при раке молочной железы чаще встречается остеолитический, иногда смешанный типа метастатического поражения костей. Для остеолитического типа характерен гипоинтенсивный МР-сигнал от костного мозга в Т1ВИ. В режиме подавления сигнала от жировой ткани, а также в режиме Т2ВИ наиболее часто (71%) отмечался смешанный неоднородный сигнал, при небольших поражениях определялась высокая интенсивность сигнала. Отметим, что хотя большинство костных метастазов при РМЖ и является по своей сути остеолитическими, нередко на поздних стадиях заболевания, а также высоко агрессивном характере роста, отмечается наличие мягкотканого компонента, распространяющегося на окружающие ткани, в том числе в позвоночный канал (Рис 1.)
Рисунок 1. Инфильтративно-дольковый рак молочной железы. Состояние после комплексного лечения. Магнитно-резонансная томография грудного отдела позвоночника, сагиттальная проекция. А) Т2ВИ - множественное очаговое поражение тел грудных позвонков, тотальное диффузное поражение тела Th12, с частичным разрушением верхней и нижней кортикальной пластины. Б) FatSat– слабогиперинтенсивный МР-сигнал от тел пораженных позвонков, смешанный сигнал от тела Th12. В) Т1ВИ - гипоинтенсивный сигнал от всех пораженных позвонков.
Для оценки распространенности процесса и степени инвазии на окружающие ткани предпочтительно использование Т1ВИ, проведенные нативно и на фоне внутривенного введения парамагнетика. На постконтрастных изображениях четче визуализируется распространение мягкотканого компонента на окружающие ткани, глубина инвазии и соотношение с неизменными мягкими тканями. Характерным признаком метастатического поражения является, так называемый, «феномен выравнивания», когда гипоинтенсивный сигнал от пораженного позвонка после внутривенного контрастирования становится изоинтенсивным по отношению к телам неизмененных позвонков. Данный эффект, по всей видимости, является отображением патологической васкуляризации, что характерно для злокачественной природы изменений. Также следует отметить, что введение парамагнетика не влияет на визуализацию изначально гиперинтенсивных образований на Т1ВИ, таких как, например, гемангиома, участки жировой инволюции костного мозга (Рис. 2).
Рисунок 2. Инфильтративно-протоковый рак молочной железы. Магнитно-резонансная томография поясничного отдела позвоночника, сагиттальная проекция. Метастатическое поражение 5го поясничного позвонка. А)Т2ВИ – гипоинтенсивный диффузный сигнал в теле L5, соответствующий метастатическому поражению. В телах L1, L2, L3 гиперинтенсивные округлые очаги. Б) FatSat– гиперинтенсивный МР-сигнал в теле L5, занимающий все тело позвонка. Изоинтенсивный сигнал в теле L2 – жировая инволюция костного мозга. В телах L1, L3 гиперинтенсивные очаги - гемангиомы. В) Т1ВИ. Диффузный гипоинтенсивный МР-сигнал от L5 позвонка. Гиперинтенсивные очаги в L1, L3- гемангиомы, в теле L2- жировая инволюция костного мозга. Г) Т1ВИ +С. В теле L5 отмечается накопление парамагнетика, «феномен выравнивания сигнала». Гемангиома в теле L1- контрастное усиление, в теле L3 гиперинтенсивный МР-сигнал без изменений. Артефакты от движения вызванные болевым синдромом.
При компрессионных переломах у 6 пациентов (9%) отмечалось наличие смешанного костно-мягкотканного компонента за счет хаотично расположенных участков разрушенной кости, а также костных включений в результате репаративного действия остеобластов на фоне пролиферативной активности опухолевых клеток. При метастатической природе перелома часто имеется несоответствие сниженной высоты тела и выраженности мягкотканого компонента, что свидетельствует о наличии дополнительного опухолевого компонента «плюс-ткань» (Рис.3).
Рисунок 3. Инфильтративно-дольковый рак молочной железы. Магнитно-резонансная томография, метастатическое поражение позвоночника. А) Т2ВИ, сагиттальная плоскость. Патологический перелом Th10, L2 позвонков с распространением процесса на паравертебральные ткани. Множественное очаговое поражение тел позвонков. Б) Нижнее-грудной верхне-поясничный отдел позвоночника, Т2ВИ, корональная плоскость. Патологический перелом Th10, L2 позвонков с наличием мягкотканого компонента. В) Т2ВИ, аксиальная плоскость, уровень Th10. Патологический перелом тела позвонка, с распространением опухолевого процесса в позвоночный канал, на паравертебральные ткани справа, поражение правого остистого отростка, правого реберно-позвоночного сочленения.
С целью получения дополнительной информации о характере метастатических изменений, а также сопоставления данных магнитно-резонансной томографии с морфологической картиной проведен секционный анализ 5 умерших больших с диагнозом инфильтративный рак молочной железы. На препаратах визуализировалась очаги костной деструкции в телах позвонков, с разрушением м/п дисков, замыкательных пластинок, в 3х случаях отмечалось наличие экстравертебрального мягкотканого компонента с хаотично расположенными костными включениями (Рис.4). При сопоставлении степени распространенности и характера опухолевого поражения данные МРТ во всех случаях совпали с данными патологоанатомического вскрытия.
Рисунок 4. А) Метастаз инфильтративного рака в телах 4 и 5 грудных позвонков. Макропрепарат, фронтальный распил позвоночного столба. Очаги литической деструкции губчатого вещества тел позвонков. Деструкция межпозвонкового диска. Компрессионный патологический перелом 5 позвонка. Фиброз задней продольной связки. Б) Сагиттальный распил позвоночного столба. Компрессионный перелом. Разрыв передней продольной связки в месте крепления м/п диска.
Выводы
По данным проведенного исследования можно сделать вывод об отсутствии специфической МР-семиотики метастатического поражения костей при различных вариантах инфильтративного рака молочной железы. Уровень поражения, глубина инвазии, наличие костно-деструктивных изменений, степень распространения на мягкие ткани находят полное отображение при высокопольной магнитно-резонансной томографии, что подтверждается патологоанатомическими данными.