(Новости лучевой диагностики 2001 1-2: 29-31)
Маммография в комплексной диагностике рака молочной железы.
Илькевич А. Г.
НИИ онкологии и медицинской радиологии им. Н.Н.Александрова, г. Минск.
В институте онкологии и медицинской радиологии им. Н.Н. Александрова течении многих лет использовалась маммография для диагностики опухолей молочных желез. Однако в силу технических причин информативность снимков, выполняемых на аппарате TUR, была недостаточной.
В настоящее время в институте применяется прогрессивная методика исследования молочных желез, позволяющая не только выявить злокачественное заболевание на ранней стадии его развития, но и морфологически верифицировать диагноз, даже если клинически патологическое образование не определяется.
Маммография обладает высокой чувствительностью: на снимках можно определить около 81-96% всех патологических изменений. Рентгенологическое исследование молочных желез проводится в специальном кабинете на рентгеновской установке – маммографе "Mammomat - 3000" фирмы Siemens, оснащенном трубкой с молибденовым анодом, а также молибденовым и родиевыми фильтрами. Такое сочетание обеспечивает оптимальное излучение и получение наиболее информативного изображения. Маммографический кабинет также укомплектован специальными кассетами с одним усиливающим экраном повышенной разрешающей способности и специальной пленкой с односторонним покрытием светочувствительным материалом. Процесс фотообработки пленки проводится в проявочном автомате.
Огромное внимание уделяется качеству производства снимков, жестко контролируется весь технологический процесс - от правильной укладки молочной железы, выбора режима экспонирования до параметров работы проявочной машины, что позволяет получить высококачественные при минимальной лучевой нагрузке.
Рентгенологическое изображение молочной железы чрезвычайно вариабельно и многогранно, имеется множество симптомов, большинство из которых не патогномонично только для рака (Рис. 2). Прямыми рентгеновскими признаками рака молочных желез являются наличие тени самой опухоли и характерных для злокачественного заболевания кальцинатов.
Симптом лучистой тени хорошо известен и его интерпретация обычно не представляет сложностей. Чаще всего такая тень отражает инфильтративное распространение злокачественной опухоли. Обызвествления при раке молочной железы напротив, отражают внутрипротоковый неинфильтративный рост раковых клеток, в связи с чем интерпретации характера кальцинатов придается все большее значение.
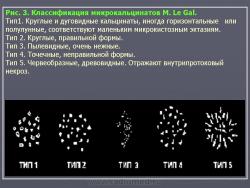
Все обызвествления, выявляемые на маммограммах, мы делим на макрокальцинаты, размером более 0.5 мм и микрокальцинаты, размерами менее 0.5 мм. Первые чаще наблюдают при доброкачественных процессах и не представляют трудностей в оценке. Наиболее сложна интерпретация микрокальцинатов. В институте мы пользуемся современной классификацией микрокальцинатов M. Le Gal, согласно которой все микрообызвествления делятся на 5 типов (Рис. 3).
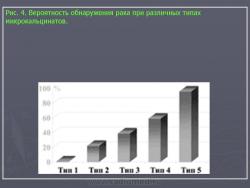
Типы микрокальцинатов важно различать на маммограммах, т.к. вероятность обнаружить рак при различных обызвествлениях колеблется от 1% до 96% (Рис. 4).
К косвенным симптомам рака молочной железы относятся следующие:
1. Фиброзная реакция стромы - конвергенция соединительнотканных пучков или дезорганизация архитектоники ткани. В ранних стадиях развития опухолей фиброзная реакция стромы может быть единственным элементом, манифестирующим наличие начального рака.
2. «Симптом тента» (симптом шатра) – втяжение края железистого треугольника. При наличии этого признака необходимо дополнить исследование касательными снимками для выявления утолщения и втяжения кожи.
3. Отек ткани молочной железы – может соответствовать нарушению лимфооттока и вторичному воспалительному процессу, опухолевой инфильтрации при достаточно поверхностном расположении ракового узла.
Если после выполнения стандартной маммографии диагноз остается неясным или выявляются только симптомы, подозрительные в отношении рака, применяются дополнительные способы рентгенологического обследования, в частности, прицельная рентгенография с локальной компрессией молочной железы, рентгенография в косой проекции. В значительной части случаев указанные мероприятия позволяют уточнить истинный характер нозологического процесса.
В неясных случаях, случаях клинико-рентгенологического расхождения, при высокой рентгенплотности ткани молочной железы применяется ультразвуковое исследование молочной железы, которое осуществляется на обычных ультразвуковых аппаратах, оснащенных датчиками с частотой сигнала 7.5 МГц или 10 МГц. При этом можно определить структуру (жидкость или ткань) выявленной при рентгенографии тени, в частности, дифференцировать кисты и опухоли, визуализировать внутрикистозные разрастания, выявить некоторые рентгенонегативные очаговые образования и другие изменения структуры молочной железы, не видимые на рентгенограммах (Рис. 5). Данный метод обладает положительными качествами - быстротой и простотой методики обследования, возможностью выполнения прицельной толсто- и тонкоигольной пункционной биопсии под ультразвуковым контролем, что в ряде случаев существенно упрощает обследование больной. Тем не менее, ультразвуковой метод диагностики имеет ряд недостатков, не позволяющих использовать его как единственный или первичный метод исследования, т.к. примерно 30% раков не выявляются при ультразвуковом обследовании.
В случае, если подозрительная тень, определяемая на маммограмме, не пальпируется и не выявляется при ультразвуковом исследовании и, соответственно, диагноз не может быть верифицирован морфологически при пункции под ультразвуковым контролем, выполняется пункционная биопсия под рентгенологическим контролем - так называемая стереотаксическая пункционная биопсия.
Процедура проводится на специальной приставке к маммографу. Начинается исследование с прицельной маммографии одного и того же участка молочной железы с патологической тенью, под углами + и - 10 градусов. По смещению тени образования относительно центра вращения высчитываются координаты расположения цели. Затем специальными держателями подводится пункционная игла, рентгенологически контролируется ее положение и 4-5 раз осуществляется пункционная биопсия с получением столбика ткани толщиной 1.5 мм и длиной 2 см для гистологического исследования.
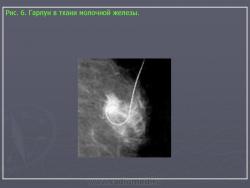
В последнее время в связи с выявлением все большего числа подозрительных теней и скоплений микрокальцинатов, приходится чаще выполнять внутритканевую предоперационную маркировку под рентгенологическим контролем. Она осуществляется на обычном маммографе при помощи компрессионной платы с отверстиями и специальных игл, содержащих металлические гарпуны. Методически это довольно простая манипуляция. Вначале производится рентгенография молочной железы в одной из проекций. На заведомо большую глубину через патологическое образование вводится игла. Bыполняется контрольный снимок под углом 90 градусов к первому и по нему корректируется глубина введения иглы. Если стояние иглы удовлетворительное, она извлекается, при этом в молочной железе остается гарпун (Рис. 6). Непосредственно за маркировкой следует хирургическое вмешательство с удалением участка ткани молочной железы с гарпуном и последующее патоморфологическое исследование.
На основании полученного опыта уточнен алгоритм обследования больных в зависимости от возраста пациентки, характера патологии, локализации изменений, предыдущего лечения и ряда других факторов. Обычно у женщин в возрасте старше 35 лет после пальпаторного исследования молочных желез в начале выполняется маммография, при необходимости дополняемая ультразвуковым исследованием. При обследовании женщин в возрасте до 35 лет. После клинического осмотра выполняется ультразвуковое исследование. Связано это с высокой рентгеновской плотностью ткани молочных желез у женщин этого возраста и вследствие этого низкой информативностью рентгенографии.



Синхронный рак молочных желез: клиника, диагностика, лечение, прогноз
И. Ю. Филюшкина, В. М. Иванов, Ю. В. Буйденок.
ГУ РОНЦ им. Н. Н. Блохина РАМН
Рак молочной железы – в настоящее время одно из самых распространенных злокачественных опухолей у женщин. В структуре онкологической заболеваемости в России рак молочной железы занимает первое место и частота его неуклонно растет. Число заболевших в 2004 году составило 49,2 тыс., а умерших - 23 тыс. Заболеваемость раком молочной железы в Москве и Санкт-Петербурге в 2004году составила 51,4 и 48,3 на 100000 населения, соответственно (М. И. Давыдов, Е.М.Аксель).
Первично-множественные злокачественные опухоли - одновременное или поочередное возникновение злокачественных опухолей. Они развиваются самостоятельно и независимо друг от друга в пределах одного или нескольких органов. Синхронный рак молочных желез - один из вариантов первично-множественного рака, и по мнению ряда авторов, является проявлением мультицентричности заболевания в парном органе. Наиболее важным признаком синхронного рака молочных желез является одновременность возникновения опухолей в обеих молочных железах, однако ряд авторов допускает возможность интервала между первой и второй опухолью в пределах 6-12 месяцев. Синхронные опухоли молочных желез выявляются достоверно реже (22,7%), чем метахронные опухоли (69,6%).
На долю рака молочной железы среди всех первично-множественных опухолей приходится от 8% до 21,9%. По данным ОНЦ РАМН, первично-множественный мультицентрический рак молочной железы составил 5,7%, синхронный рак – 0,9%, метахронный рак – 1,0%, метастатический рак молочной железы – 0,98%.
При первично- множественных синхронных злокачественных новообразованиях вторая опухоль при обследовании не диагностируется у 25,3% женщин. Совершенствование методов своевременной диагностики, выявление особенностей или закономерностей возникновения и клинического течения синхронного рака молочных желез, усовершенствование методов комплексного лечения способствуют улучшению результатов лечения, и, как следствие, увеличению продолжительности жизни больных. Основным методом диагностики рака на сегодняшний день остается маммография. T. J. Murphy и соавт. на основании изучения маммограмм 35 больных синхронным раком молочных желез пришли к выводу, что маммографические проявления синхронного рака не отличаются от таковых при одностороннем раке. Двухсторонние синхронные опухоли очень часто имеют одинаковые внешние проявления и расположены в молочных железах в виде «зеркального отображения». Маммографию необходимо проводить с обеих сторон, даже при поражении одной железы.
Несмотря на высокую чувствительность маммографии (92,5%), в некоторых случаях она бывает малоинформативной. Магнитно-резонансная маммография (МР-маммография) желез является дополнительным эффективным методом комплексной диагностики патологии молочных желез и реализуется при неэффективности других методов визуализации (чувствительность 99,2%, специфичность 97,9%, точность 98,9%).
МР- маммографию целесообразно использовать при:
В последнее время в литературе все чаще появляются сообщения о достаточно высокой значимости сцинтимаммографии в диагностике синхронного рака молочных желез. Имеются сообщения об использовании 99mTc-MIBI в диагностике двухсторонних опухолей молочных желез. E.Derebek и соавт. сообщают о том, что ранняя и отсроченная сцинтиграфия предоставляет важную дополнительную информацию при синхронном поражении молочных желез, даже в случаях, когда маммография и динамическая МРТ не эффективны.
Генетические факторы играют важную роль в возможной предрасположенности к возникновению синхронного рака молочных желез. Положительный семейный анамнез рака молочной железы в 2 раза чаще имеет место у больных синхронным раком молочных желез по сравнению с общей популяцией. Anderson D.E. установил, что синхронные раки, возникающие у женщин до менопаузы, являются строго наследственными и почти у 30% дочерей данной группы велика вероятность возникновения рака молочной железы в возрасте до 40 лет. Данные литературы, касающиеся этой проблемы, немногочисленны, и анализируют небольшое число наблюдений. Kinoshita T. И соавт. пришли к выводу, что генетические изменения и механизм канцерогенеза при одностороннем и двухстороннем раке молочных желез различны. A. E. Ozer и соавт., исследовав прогностическую значимость мутаций гена р53 при синхронном раке молочных желез, пришли к выводу, что выраженная степень мутаций р53, особенно в сочетании с экспрессией Ki-67 (маркером опухолевой клеточной пролиферации), является неблагоприятным фактором прогноза при синхронном раке и может служить предсказателем развития метахронного рака в контрлатеральной молочной железе. Е.М. Бит-Савва выявила, что синхронный рак молочных желез в 50% случаях ассоциирован с мутациями в генах BRCA1, BRCA2, а при сочетании этого признака наследственного заболевания с раком яичников у кровных родственников больной, герминальные мутации в генах репарации ДНК выявляются в 100% случаев.
Общая и безрецидивная выживаемость больных синхронным раком молочных желез зависит от прогностических факторов. По данным Р. А. Керимова, средний возраст больных синхронным раком молочных желез составляет 49,98 ± 2,9 года. По J.Kelmendi de Ustrann и соавт., роль других прогностических факторов (возраст; менархе; овариально- менструальная функция, время лактации, время рождения первого ребенка, соотношение между числом инвазивных и неинвазивных опухолей) одинакова при синхронном и одностороннем поражении молочных желез.
Р. А. Керимов, анализируя клинические проявления при двухстороннем раке молочных желез, показал, что у 39,5% больных синхронным раком стадийность поражения была одинаковой с обеих сторон, у 60,5% - разная. Более чем в половине случаев (59,3%) отмечены локализованные формы рака. Симметричное расположение опухолей выявлено в 22,9% случаях. Опухоли локализовались в наружных и верхних квадрантах молочных желез у 86% больных. Метастазы в регионарных лимфатических узлах были обнаружены с обеих сторон у 50% больных, с одной – у 27,9%. При синхронном поражении наиболее часто с обеих сторон отмечался инфильтративный рак: протоковый у 46,4% больных, дольковый – у 26,2% больных. У 11,9% больных установлено сочетание инфильтративного протокового или долькового рака с одной стороны и редких форм – с другой. У 73,8% больных опухоли с обеих сторон были одинакового гистологического строения, у 26,2% - различного. Исследование окружающей ткани молочной железы при синхронном раке выявило различной степени выраженности фиброзно-кистозную болезнь: в 67,3% случаев – пролиферативная форма, проявляющаяся развитием внутрипротоковых и внутридольковых пролифератов, внутрипротоковых папиллом, участков атипии эпителия. У 17,3% больных выявлены очаги неинвазивного рака.
Существенное влияние на прогноз оказывает рецепторный статус опухоли. Высокий уровень рецепторов эстрогенов свидетельствует о более благоприятном прогнозе у молодых женщин, а рецепторов прогестерона – у пожилых больных.
Распределение больных синхронным раком молочных желез по стадиям с каждой стороны следующая: T1-2N0M0 и T1-2N0M0 – у 18,6% больных; T1-2N1M0 и T1-2N1M0 – у 9,3%; T3-4N0-2M0 и T3-4N0-2M0 – у 24,4%; T1-2N0M0 и T1-2N1M0 – у 18,6%; T1-2N0M0 и T3-4N0-2M0 – у 9,3%; T1-2N1M0 и T3-4N0-2M0 – у 19,8%. Локализованные формы рака отмечены более чем в половине случаев – у 59,3% пациентов.
По данным Hong Wen-shan показатели 5- и 8-летней выживаемости у больных с отсутствием поражения метастазами лимфатических узлов, односторонним поражением лимфатических узлов и двухсторонним поражением лимфатических узлов – 75,6 и 65,5%; 43,8 и 32,9%; 28,9 и 0% соответственно.
По Р. А. Керимову 5-летняя общая выживаемость больных с I-IIа с каждой стороны составила 90,0 ± 5,6%, безрецидивная – 82,2 ± 4,8%, при IIб стадии – соответственно 75,6 ± 8,7% и 67,4 ± 9,5%, при lllа-б стадии – 50,4 ± 3,2 и 40,2 ± 3,6%; при l-llа стадии с одной стороны и llб с другой – соответственно 79,1 ± 5,3% и 69,5 ± 5,5%, при l-llа и lllа-б – 73,2 ± 8,8% и 65,3 ± 9,2%, при llб и lllа-б – 51,3 ± 4,7% и 40,4 ± 4,9%. Ранние стадии опухолей с одной стороны при наличии местно-распространенного процесса с другой очень незначительно влияют на выживаемость.
Лечение синхронного рака молочных желез весьма разнообразно и зависит от прогностических факторов. Длительное время основным методом лечения оставался хирургический – двухсторонняя радикальная мастэктомия. Однако, с усовершенствованием методов химио- и лучевой терапии, стало возможным проведение органосохраняющих операций.
При первично-неоперабельных формах рака с одной или обеих сторон комплексное лечение дает достоверно лучшие результаты, чем все прочие виды терапии. Проведение неоадъювантной терапии при местно- распространенном процессе с одной или с обеих сторон достоверно увеличивает и общую, и безрецидивную выживаемость, в то же время проведение неоадъювантного лечения при первично- операбельных стадиях не приводит к достоверному улучшению выживаемости.
До сих пор вопрос о возможности выполнения органосохраняющих операций при синхронном раке молочных желез является противоречивым. Поиском ответа на этот вопрос посвящено множество исследований последних лет. Большинство авторов считают возможным выполнение этих операций при соблюдении определенных показаний. Так, T.Arimura и соавт. показаниями к выполнению органосохраняющих операций считают опухоль менее 3-х см, отсутствие мультицентрического роста, отсутствие значительной инвазии протоков. Авторами были выполнены органосохраняющие операции при синхронном раке молочных желез у 44% больных с одной стороны и у 38% больных с обеих сторон. Показатели выживаемости в этих группах и в группе больных с мастэктомиями практически не различались. Сходные данные были получены и многими другими авторами. Во всех этих исследованиях не было получено различий в общей и безрецидивной выживаемости, частоте рецидивов. Однако, остаются еще отдельные публикации, в которых авторы являются строгими приверженцами выполнения операций большего объема при синхронном раке молочных желез.
Резюмируя проведенный выше анализ литературных данных о синхронном раке молочных желез, можно заключить, что эта проблема остается сложной и далеко не полностью изученной. Существует множество спорных вопросов, касаемых эпидемиологии, диагностики и лечения синхронного рака молочных желез.
Особенности клиники и морфологического строения опухоли у больных воспалительной формой рака молочной железы
Воспалительная форма рака молочной железы (ВФРМЖ) является редкой и чрезвычайно агрессивной опухолью. ВФРМЖ встречается примерно в 1% от всех случаев РМЖ. Характерными особенностями ВФРМЖ являются стремительное развитие клинических проявлений, быстрое прогрессирование заболевания (появление регионарных и отдаленных метастазов), резистентность опухоли к лечению и плохой прогноз.
ВФРМЖ относят к категории местно-распространенного рака, т.е. первично-неоперабельного. По международной классификации TNM (6-е издание, 2003 г.) ВФРМЖ классифицируется как Т4d.
Кривые общей (а) и безрецидивной (б) выживаемости больных ВФРМЖ
Диагноз ВФРМЖ устанавливается на основании анамнеза и клинических проявлений заболевания. Еще в 1971 г. C. Haagensen [1] описал классические клинические проявления ВФРМЖ: диффузное покраснение; отек, занимающий более одной трети молочной железы, симптом «апельсиновой корки»; диффузное уплотнение; местное повышение температуры; увеличение молочной железы в размерах; в некоторых случаях отсутствие пальпируемой опухоли. Подобные клинические проявления, с одной стороны, могут присутствовать при ряде воспалительных заболеваний молочной железы (острый мастит или рожистое воспаление молочной железы), что вызывает трудности в диагностике у клиницистов, а с другой, эти проявления могут быть вторичными в связи с нарушением лимфооттока при невоспалительных местно-распространенных формах рака молочной железы (МРРМЖ). К сожалению, более достоверных признаков в диагностике ВФРМЖ, чем клиническая картина, в настоящее время не существует. Ряд авторов полагают, что опухолевая эмболизация кожных лимфатических и кровеносных сосудов является характерным признаком ВФРМЖ. Однако в исследовании J. Low [2] было показано, что данный признак в равной степени может как присутствовать, так и отсутствовать у больных ВФРМЖ. Более того, достоверной разницы в выживаемости у больных с инвазией поверхностных сосудов и без нее не наблюдается.
Подтверждение диагноза ВФРМЖ осуществляется так же, как и при других формах РМЖ. Выполняют рентгенологическое и ультразвуковое исследование молочных желез. Трепанобиопсия позволяет получить информацию о гистологическом строении и степени злокачественности опухоли, опухолевом статусе рецепторов эстрогенов и прогестерона (РЭ, РП) и Her-2-статусе. Данная информация позволяет прогнозировать течение заболевания и планировать лечение, которое, как правило, начинается с химиотерапии. В нашем исследовании использовалась информация о 201 больной ВФРМЖ, леченной в НИИ онкологии им. Н.Н. Петрова с 1985 по 2002 г. Средний возраст больных составлял 50 лет (от 29 до 73 лет). Больные были распределены на следующие возрастные группы: до 35 лет, 35-45 лет, 45-50 лет и старше 50 лет. При оценке отдаленных результатов лечения наихудшие результаты наблюдались в группе больных до 35 лет: общая 10-летняя выживаемость составила 13%, а до 15-летней отметки не дожила ни одна больная.
Больных в пре- и постменопаузе было примерно поровну - 52 и 48% соответственно. Статистически достоверных различий в непосредственных и отдаленных результатах лечения между этими группами больных выявлено не было. Биологические характеристики опухоли определяли либо по материалу, полученному при трепанобиопсии, либо на основании послеоперационного материала. Биологические характеристики опухоли изучали в другом рандомизированном исследовании, проведенном на базе 1-го хирургического отделения ГУН НИИ онкологии, включавшем 72 больных МРРМЖ, в том числе 12 больных ВФРМЖ. Сравнивались группы больных IВ ВФРМЖ и ШВ МРРМЖ.
Гистологическая степень злокачественности определялась по Ellis and Elston. При оценке результатов было выявлено, что высокая степень гистологической злокачественности встречалась у 50% больных ВФРМЖ и лишь у 27% больных МРРМЖ. При оценке непосредственных результатов лечения количество полных патоморфологических ответов наблюдалось в 2 раза чаще в группе с высокой степенью гистологической злокачественности. Однако при сравнении отдаленных результатов лечения статистически достоверных различий между группами выявлено не было. Больные также были стратифицированы по статусу РЭ/РП. Было выявлено, что в группе больных ВФРМЖ РЭ/РП-отрицательные опухоли встречались в 2 раза чаще, чем РЭ/РП-положительные (67% против 33%). В группе больных МРРМЖ наблюдалась противоположная картина - РЭ/РП-положительные опухоли встречались в 63% случаев. При оценке непосредственных результатов лечения частота полных патоморфологических ответов была в 6 раз выше в группе больных с РЭ/РП-отрицательными опухолями, однако показатели общей 5-, 10- и 15-летней выживаемости в этой группе больных были ниже.
У 75% больных ВФРМЖ выявлена протоко-вая форма РМЖ, и лишь у 7% - дольковая. У 18% больных определить гистологический тип опухоли не представлялось возможным из-за изменений, происшедших на фоне лечения. При оценке непосредственных результатов лечения в этих группах больных не выявлено различий в частоте полных патоморфологических ответов. Однако при оценке отдаленных результатов была выявлена тенденция к более высокой 3-, 5- и 10-летней выживаемости в группе больных с дольковым строением рака, в которой 10-летняя общая выживаемость составила 52%, тогда как в группе больных с протоковым РМЖ - лишь 32%. У всех больных определяли экспрессию Her-2/neu. В группе больных ВФРМЖ Her-2-положительные опухоли встречались в 3 раза чаще, чем Her-2-отрицательные (75 и 25% соответственно), в то время как в группе больных МРРМЖ наблюдалось равное распределение больных по Her-2/neu-статусу (по 50%).
Таким образом, на основании полученных данных можно сделать вывод, что ВФРМЖ является особой формой заболевания, которой присущи высокая степень гистологической злокачественности (50%), протоковая форма (75%), РЭ/РП-отрицательный статус (67%) и Her-2/neu-положительный статус (75%).
ВФРМЖ характеризуется плохим прогнозом в отношении жизни и рецидива заболевания.
В нашем исследовании медиана наблюдения за больными составила 9 лет, а общий период наблюдения достиг 15 лет. При этом 15-летняя общая выживаемость составила 26%, а 15-летняя безрецидивная выживаемость - 24%, медиана продолжительности жизни до прогрессирования - 3,1 года, а до смерти 5,1 года (см. рисунок). Лечебная тактика, которая применялась для лечения больных ВФРМЖ, была различной. До 1990 г. в качестве предоперационного лечения больные получали химиотерапию по схеме CMF, а начиная с 1990 г. приоритетной схемой была химиотерапия, включавшая антрациклины (FAC, FEC), - от 4 до 6 циклов с последующей предоперационной лучевой терапией в случае неэффективного лечения.
Коренным образом изменилась и тактика хирургического лечения. Так, до 1990 г. наиболее часто выполнялась операция Холстеда, тогда как с 1990 г. объем операции уменьшился до мастэктомии по Пэйти - Дайсону. С 2000 г. в схему первичной химиотерапии были включены таксаны (паклитаксел, доцетаксел) в комбинации с антрациклинами, от 4 до 8 циклов, а больным с Her-2/neu-положительными опухолями стал назначаться трастузумаб 1 раз в 3 нед в течение 12 мес в качестве адъювантного лечения. За время наблюдения у 1% больных наблюдался локорегиональный рецидив, у 56% - отдаленные метастазы и у 3% - сочетание отдаленного метастазирования и локорегионального рецидива. Наиболее частой локализацией отдаленных метастазов у больных ВФРМЖ являлись легкие, кости и печень. Средняя продолжительность жизни до и после установления прогрессирования равнялась 2,34 и 1,23 года соответственно.
Таким образом, ВФРМЖ можно характеризовать как особую форму заболевания с низкими показателями выживаемости и небольшими сроками жизни до и после прогрессирования заболевания.
По данным литературы, включение в схему системного лечения ВФРМЖ современных препаратов (паклитаксел, доцетаксел, капецитабин, гемзар, препараты платины), дополнямых трастузумабом при Her-2-положительных опухолях, значительно увеличивает эффективность терапии.
Авторы: К.Ю. Зернов, В.Ф. Семиглазов, А.А. Божок, С.Г. Петровский, А.А. Орлов, Э.Э. Топузов, Р.М. Палтуев, П.В. Криворотько, В.Г. Иванов
НИИ онкологии им. проф. Н.Н. Петрова, Санкт-Петербург
Классификация злокачественных опухолей (TNM)* (под редакцией проф. Н.Н. Блинова)
Опухоли молочной железы (ICD-0 C50)
Область описывается по следующим критериям.
Группировка по стадиям. Правила классификации
Классификация применима только для рака. Должно быть гистологическое подтверждение диагноза. Анатомическая часть, где развивается опухоль, фиксируется, но не учитывается при классификации. В случае одновременного развития нескольких опухолей в одной железе категория T определяется по наибольшей. Одновременно возникшие билатеральные опухоли классифицируются отдельно.
При оценке T, N и M используются следующие методы:
Анатомические части
* Настоящий перевод «TNM - Классификация злокачественных опухолей. Шестое издание» опубликован по лицензии, полученной от John Wiley &Sons International Rights, Inc. 16.08.02. ЭСКУЛАП, - 2003.
Регионарные лимфатические узлы
Регионарными лимфатическими узлами являются следующие.
Примечание. Интрамаммарные лимфатические узлы кодируются как аксиллярные (подмышечные).
Любые другие лимфатические узлы, пораженные метастазами, включая шейные или контралатеральные внутренние лимфатические узлы молочной железы, обозначаются как отдаленные метастазы M1.
Клиническая классификация TNM
Примечание. Болезнь Педжета, при которой пальпируется опухолевый узел, классифицируется по его размерам.
Примечание. Микроинвазия - распространение опухолевых клеток через базальную мембрану в прилегающие ткани фокусом не более 0,1 см в наибольшем измерении. При наличии множественных фокусов классификация проводится по наибольшему измерению. Нельзя использовать сумму фокусов. Наличие множественных фокусов должно быть отмечено, так же как это делается при множественных инвазивных карциномах.
Примечание. Грудная стенка включает ребра, межреберные мышцы, переднюю зубчатую мышцу, но не включает грудные мышцы.
Примечание. Воспалительная форма рака молочной железы характеризуется диффузным утолщением кожи с плотными краями, обычно без подлежащей пальпируемой массы. Если биопсия кожи отрицательна или нет локализованной опухолевой массы, при патологической классификации используется категория pTx, а при клинической - T4d. При оценке категории pT определяется инвазивный компонент. Втяжение кожи, ретракция соска или другие кожные изменения, за исключением относящихся к T4b и T4d, могут оцениваться как T1,T2 и T3, не влияя на классификацию.
N - Регионарные лимфатические узлы
Примечание. Клинически определяемые означает выявление метастазов в лимфатических узлах при физикальном осмотре или методах визуализации (исключая лимфосцинтиграфию)
М - Отдаленные метастазы
Категории M1 или pM1 могут быть дополнены в зависимости от локализации отдаленных метастазов:
Легкое
риг
Кости
OSS
Печень
ИГР
Головной мозг
BRA
Лимфатические узлы
ГУМ
Другие
ОТН
Костный мозг
MAR
Плевра
РГГ
Брюшина
PER
Надпочечники
ADR
Кожа
SKI
Патологоанатомическая классификация pTNM pT - Первичная опухоль
Патологоанатомическая классификация требует исследования первичной опухоли, по краю произведенной резекции не должно быть опухолевой ткани. Если по краю резекции имеется лишь микроскопическое распространение опухолевой ткани, то случай может классифицироваться как pT.
Категории pT соответствуют категориям T.
Примечание. При классификации pT обязательно измеряется инвазивный компонент. При наличии большого (4 см) in situ компонента и маленького ивазивного (0,5 см) опухоль оценивается как pT 1а.
pN - Регионарные лимфатические узлы
Для определения патологоанатомической классификации необходимо иссечение и исследование хотя бы нижних подмышечных лимфатических узлов (I уровень). В подобном эксцизионном материале должно содержаться не менее 6 лимфатических узлов. Если лимфатические узлы негативны, а исследовано менее 6, классифицируется как pN0.
Для уточнения патоморфологической классификации используется исследование одного или нескольких сторожевых лимфатических узлов. Если классификация основывается только на данных биопсии сторожевых лимфатических узлов без дополнительного исследования подмышечных лимфатических узлов, то она кодируется (sn), например, pN1(sn).
Примечание. При наличии в регионарных лимфатических узлах только изолированных опухолевых клеток (ИОК) данный случай классифицируется как pN0. Единичные ИОК или в виде небольших скоплений (не более 0,2 мм в наибольшем измерении) обычно диагностируются иммуногистологическими или молекулярными методами, но могут выявляться и при окраске гематоксилином/эозином. ИОК обычно не проявляют метастатическую активность (пролиферация или стромальная реакция).
Примечание. * Не определяются при клиническом обследовании или визуализации (исключая лимфосцинтиграфию).
** Определены при клиническом обследовании или методами визуализации (исключая лимфосцинтиграфию).
Категории pM соответствует категориям M.
Классификация R
Наличие или отсутствие резидуальных опухолей после лечения обозначается символом R.
Группировка по стадиям
Материал взят из журнала "Маммология", №4, 2006
Факторы риска развития рака молочной железы
The paper gives the current data on the major risk factors that significantly affect the occurrence of breast cancer. Potential criteria for a risk, as well as factors that significantly reduce the risk of its incidence are identified. The impact of hormone replacement and correction therapies on the incidence of breast cancer is considered. Major hereditary syndromes, including breast cancer, are determined.
Рак молочной железы (РМЖ) - одна из самых актуальных проблем современной клинической онкологии, поскольку в структуре заболеваемости женского населения этой патологии принадлежит первое место в большинстве экономически развитых стран Европы и Северной Америки.
Что касается нашей страны, то в 2004 г. в России выявлено 47 805 пациенток со злокачественными новообразованиями молочных желез при ежегодном приросте заболеваемости, соответствующем 8,5%. Статистические данные свидетельствуют также и о высокой смертности от рака этой локализации (22 0054 пациентки в 2004 г.) при удельном весе в структуре смертности 16,5%. Таким образом, для нашей страны проблема РМЖ также весьма значима. Решение ее представляется возможным по нескольким фундаментальным направлениям: выполнение скрининговых программ в целях максимальной выявляемости ранних форм, а также определение групп риска в зависимости от комплекса соответствующих факторов, с высокой вероятностью приводящих к развитию неоплазии, совершенствование лечебной стратегии.
По имеющимся данным, около 66% женщин не имеют представления о факторах риска. Естественно, что знания по этому вопросу позволили бы увеличить обращаемость к специалистам - маммологам.
Факторы риска можно разделить на несколько групп:
Факторы, повышающие риск
Пол. Соотношение заболевших РМЖ мужчин и женщин равно 1:135.
Возраст. РМЖ - болезнь менопаузального и постменопаузального периода. Не более 10% пациенток заболевают РМЖ в возрасте до 30 лет. Однако с 25 до 65 лет риск заболеваемости возрастает в 6 раз. Около 17 из 1000 женщин в возрасте 60 лет с высокой вероятностью заболеют раком данной локализации в течение 5 лет, т.е. наибольшим риском отличается возрастной интервал 60-65 лет.
Состояние репродуктивной сферы. Еще в 1961 г. было показано, что нерожавшие женщины имеют более высокий риск заболеть РМЖ по сравнению с рожавшими и имевшими беременность до 20 лет. Более того, женщины, впервые рожавшие до 18 лет, имеют значительно меньше шансов заболеть по сравнению с теми, первые роды которых произошли в возрасте 25 лет и старше (риск повышен на 40%).
Наличие в анамнезе абортов, особенно до первых родов, также является фактором риска.
В 2-2,5 раза увеличивается заболеваемость в группе женщин, у которых рано наступает менархе (до 13 лет) и, наоборот, поздно - менопауза (после 55 лет).
Нарушение функции яичников, воспалительные процессы способны повышать частоту неоплазий молочных желез. Нарушения гормонального гомеостаза, нарушения функции яичников, различного рода воспалительные состояния существенным образом влияют на частоту возникновения РМЖ.
Гормональные факторы. В литературе последних лет широко обсуждается влияние заместительной гормонотерапии на заболеваемость РМЖ. Позитивное воздействие данного лечения, особенно в менопаузе, несомненно, но, с другой стороны, вполне возможно предположить реализацию негативных эффектов эстрогенов на ткань молочной железы.
В большинстве исследований заместительную гормонотерапию считают спорным фактором риска, указывая на некоторое увеличение заболеваемости лишь во время ее применения (2,1%). Отмена терапии снижает вероятность неоплазии, а срок использования с минимальным риском исчисляется двумя годами. Нежелательным является применение синтетических эстрогенов в период беременности.
Оральные контрацептивы - наиболее эффективный способ предохранения от нежелательной беременности. Эти препараты давно и прочно заняли свое место в гинекологической практике. С другой стороны, содержащиеся в них компоненты не могут не оказывать прямого влияния на ткань молочных желез. Насколько это способно повысить риск возникновения патологии молочных желез? Незначительное увеличение процента женщин, заболевших РМЖ, отмечается при непрерывном применении оральных контрацептивов более 10 лет. В остальных клинических ситуациях увеличения риска заболеваемости не отмечалось. Более того, подобные препараты часто используются в качестве эффективной коррекции при некоторых вариантах фиброзно-кистозной болезни.
Фиброзно-кистозная болезнь (мастопатия, дисгормональная дисплазия). Мастопатия - широко распространенная диффузная или узловая патология молочных желез, которой, по статистике, страдают 53-62% женщин. Многообразие специфических изменений, отраженное в классическом описании мастопатии (ВОЗ), звучит следующим образом: это - дисгормональный гиперпластический процесс, характеризующийся широким спектром пролиферативных и регрессивных изменений в ткани молочной железы с ненормальным соотношением эпителиального и соединительно-тканного компонентов.
С морфологических позиций выделяют 3 варианта фиброзно-кистозной болезни в зависимости от степени пролиферативной активности эпителия:
Риск увеличения заболеваемости минимален при непролиферативной форме мастопатии, однако возрастает в 2-4 раза по мере нарастания пролиферативной активности, достигая наиболее высоких цифр (до 22 раз) при атипической пролиферации эпителия, особенно у женщин с семейной отягощенностью.
Генетический фактор. Предположение о наследственном характере РМЖ было сделано после изучения клинических особенностей возникновения процесса. Так называемые семейные раки характеризуются следующим:
В 1990 г. был картирован первый ген, ответственный за возникновение наследственных форм РМЖ - BRCA I (17g 12-21). Его экспрессия увеличивает общий риск до 85%, причем в 33- 50% случаев - в возрасте до 50 лет и в 56-84% - после 30 лет. Общий риск в популяции соответствующих возрастов равен 2 и 7% соответственно. Однако последующие исследования продемонстрировали, что экспрессия BRCA I является более специфическим маркером рака яичников, сочетающегося с РМЖ (увеличение риска до 44% вне зависимости от возраста). Вскоре после открытия гена BRCA I возникло предположение о существовании второго гена-супрессора, более специфичного для РМЖ, и этот ген - ген BRCA II (13g 12-13) - был обнаружен. Его экспрессия увеличивает риск развития высокодифференцированных форм рака с низким митотическим индексом до 85%.
Необходимо также упомянуть о ряде генетических синдромов, в первично-множественные опухоли при которых входит РМЖ:
Ионизирующая радиация. В большом количестве исследований доказано непосредственное влияние ионизирующего излучения на риск развития РМЖ. Экспозиционная доза в 100 рад увеличивает риск втрое. Причем чрезвычайно важен возраст, когда пациентка подверглась радиационному воздействию: особенно опасен в этом отношении период до 30 лет (при пике между 15 и 18 годами). Аналогичная закономерность прослеживается у пациенток, получивших лучевую терапию как компонент комплексного лечения другой онкологической патологии. Так, применяемое при лечении лимфомы Ходжкина облучение увеличивает риск заболеваемости РМЖ, особенно у молодых больных с тенденцией к билатеральному поражению.
Алкоголь. Значимым фактором риска алкоголь становится при ежедневном употреблении не менее 50 мл, что повышает заболеваемость в 1,4-1,7 раза, особенно при сочетании с другими отрицательными факторами риска (семейный анамнез и т. д.).
Вторую группу составляют так называемые потенциальные факторы риска, из которых активно обсуждается диетический фактор. Компоненты питания играют важную роль по крайней мере для одной трети всех злокачественных опухолей. По мнению ряда авторов, пища, богатая жирами, активно влияет на возникновение и развитие некоторых неопластических процессов, к которым относится и РМЖ. Возможные механизмы этого влияния сводятся к следующему:
В противоположность этому употребление растительной пищи, морепродуктов, растительных масел (оливковое и т. д.) большинством исследователей признается весьма полезным, особенно при сопутствующих ожирении и гипертонической болезни.
И, наконец, к факторам, которые достоверно снижают риск заболеваемости РМЖ, относятся:
Таким образом, рассмотрев большинство факторов риска, с определенной долей оптимизма можно предположить, что уменьшая или полностью блокируя тот или иной фактор или все вместе, мы сможем значительно продвинуться в предупреждении такого грозного заболевания, как РМЖ.
Авторы: В.П. Летягин, И.В. Высоцкая, Е.А. Ким ГУ РОНЦ им. Н.Н. Блохина РАМН, ММА им. И.М. Сеченова
RISK FACTORS OF BREAST CANCER
V.P. Letyagin, I. V. Vysotskaya, Ye.A. Kim
N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences, I.M. Sechenov Moscow Medical Academy
Материал взят из журнала "Маммология", №4, 2006
Рак молочной железы.
Продолжение.
Заболевания молочной железы, сопровождающиеся синдромом втянутого соска:
клинические проявления, лучевая диагностика.
Шевченко С.А., Уральская государственная медицинская академия (кафедра онкологии), ФГУ «Российский научный центр рентгенорадиологии Росмедтехнологии»
Резюме
Обзор посвящен современным методам доклинической, клинической и инструментальной диагностики доброкачественных и злокачественных процессов, сопровождающихся втяжением соска. Большинство разработанных методик диагностики заболеваний молочной железы не полностью раскрывают причины втяжения соска, не используется комплексного их применения, что затрудняет раннюю диагностику ряда заболеваний, в том числе, и рака молочной железы.
Высокая частота ошибок на амбулаторно-поликлиническом этапе при распознавании заболеваний, приводящих к втяжению соска, обусловлена многообразием и сходством их проявлений, сложностью интерпретации результатов обследования [35, 48, 56, 60, 106, 116, 125, 145].
По данным Н. И. Рожковой (2000), втяжение соска встречается у 4,8% женщин старше 45 лет. Как врожденная патология это состояние отмечается в 3,9% случаев преимущественно у лиц молодого возраста. Двусторонние изменения сосков наблюдаются у 7,7% женщин [106, 132]. В 15% случаев изменения соска сопровождаются патологической секрецией, в 9,1% наблюдений выделения из соска обусловлены внутрипротоковыми папилломами, в 3,6% – цистаденопапилломами [71, 147, 160].
Большинство авторов сходятся во мнении, что наиболее частой причиной втяжения соска являются фиброзные изменения в околососковой области (36,5%), обусловленные жировым некрозом или плазмацитарным маститом за счет утолщения и склерозирования стенок протоков и вовлечения их в лимфоидно-плазмацитарный инфильтрат. Впоследствии это приводит к склерозированию протоков и окружающих тканей и может вызвать при близком расположении к соску его втяжение [45, 102, 106, 119, 133, 144, 158, 183].
Втяжением соска могут сопровождаться рак Педжета и другие гистологические варианты рака молочной железы, хронический неспецифический мастит, цистаденопапилломы, фиброаденомы, гинекомастия, узловой фибросклероз и такие редкие заболевания, как карциноид молочной железы, паразитарное поражение соска, синдром Шерешевского – Тернера [57, 63, 65, 66, 69, 84, 88, 117, 121, 125, 130, 137, 168, 170,174, 175].
В работах Ewing(1924 – 1929), основанных только на клинических данных, описаны основные признаки плазмаклеточного мастита (эктазии крупных протоков, перидуктального мастита, комедомастита, варикоцельной опухоли, нонпуэрперальной секрекции, болезни Bloodgoodи пр.). Так, плазмаклеточный мастит – подострое, чаще одностороннее, заболевание молочных желез, протекающее почти без нагноения; оно выявляется у много рожавших женщин после прекращения лактации, сопровождается болевыми ощущениями, покраснением кожи, выделениями из соска различного характера; склонен к регрессии; в подостром течении может иметь классическую картину рака молочной железы [125, 132, 133,144, 158].
C. Cromarи Dockerty (1941), обобщив данные клиники Мэйо за 30 лет, установили, что из 24 наблюдений плазмаклеточного мастита в 17 случаях был ошибочно постановлен диагноз РМЖ. B. Ferrara(1955) изучил данные обследования 76 женщин, E. Kessler, Y. Wolloch(1972) установили, что в патогенезе идиопатического (гранулематозного) плазмацитарного мастита главную роль играет аутоиммунный процесс [74, 106]. С точки зрения И. В. Высоцкой, В. П. Летягина (1997) в основе данного заболевания лежит расширение протоков с выходом содержимого в окружающую ткань, а воспалительная реакция возникает вторично. По данным T. J. Andersenetal. (1983) средний возраст женщин с диагнозом «плазмацитарный мастит» – 32 года, втянутый сосок встречался в 24% наблюдениях. В РОНЦ с 1965 по 1985 г. было прооперировано 67 больных с предположительным диагнозом РМЖ, при гистологическом исследовании у 34 человек было выявлено хроническое воспаление молочной железы с втяжением соска у 25 больных; у 33 - плазмаклеточный мастит с втяжением соска у 19 человек [42]. Характерные для данного заболевания патогомоничные клинические, рентгенологические и сонографические признаки в литературе не описаны.
Гнойные и негнойные формы хронического неспецифического мастита также приводят к втяжению соска за счет образования мелких абсцессов с выраженной индурацией окружающих тканей. О сложности дифференциальной диагностики говорили Г. Э. Измайлова (1988), Н. И. Рожкова (2000), JM. Dixon(1989). Gunhan-Bildenetal. (2002) обследовав 2733 женщин, дифференцировали мастит с воспалительной карциномой молочной железы в 43% случаев, с пальпируемой опухолью и увеличенными аксиллярными лимфатическими узлами – в 57%.
Рак Педжета(внутрипротоковый эпидермотропный рак) составляет 0,7– 9,2% от числа опухолей молочной железы и возникает в устье выводных млечных протоков соска. По мнению английского хирурга J. Paget(1874), заболевание обусловлено связью хронического поражения кожи соска и ареолы с карциномой молочной железы. Автор описал 15 наблюдений, основанных лишь на клинических данных, и привел основные признаки заболевания. В последующих исследованиях клиническая картина была дополнена новыми симптомами. Главные из них – симптомы со стороны соска – возможность его втяжения на ранних этапах развития болезни [63, 74, 121].
В доступной литературе удалось найти описание 1364 случаев заболевания раком Педжета молочной железы. Наибольшее число наблюдений (214) представили R. Archikari et al. (1973). В исследованиях Е. М. Погодиной,
Г. В. Летягиной (1993) представлены результаты обследования и лечения 121 больной первичным раком Педжета. Изменения соска как первый симптом наблюдали у 65,5% больных, в 50% поражалась только кожа соска, в 40% выявляли пальпируемую опухоль, в 10% диагноз был поставлен лишь при микроскопии. В 35,5% случаев рак Педжета сочетался с опухолью молочной железы другой гистологической формы. Рак Педжета сопровождался серозными и кровянистыми выделениями из соска, жжением, зудом, появлением эрозивной поверхности на соске и корочки. Дифференциальный диагноз проводили с экземой соска, аденоматозом, кератозом, меланомой, эрозивным папилломатозом, нейрофиброматозом, расширением млечных ходов, подареолярными кистами [5, 34, 35, 60, 67, 74, 111]. Диагноз ставился на основании обнаружения специфических клеток Педжета в опухолевом узле молочной железы при гистологическом исследовании операционного препарата [108, 113, 118. 182].
Экстрамаммарная болезнь Педжета – редкое, труднодиагностируемое заболевание, встречается в виде множественных очагов аденокарциномы в эпидермисе, распространяющихся по волосяным фолликулам и потовым железам. [106, 108].
Несмотря на известную клиническую картину, диагностика рака Педжета весьма затруднительна, поскольку объективные рентгенологические, сонографические симптомы этого заболевания не описаны.
Нередко втяжение соска обусловлено РМЖ, локализующимся около соска. В 22% случаев опухолевый узел располагался близко к соску или при больших размерах опухоли имелась «дорожка» к соску и утолщенная втянутая ареола [5, 60, 68, 76, 103, 110, 166]. В 60% случаев РМЖ сопровождался кровянистыми выделениями из соска, в 35% – серозными [71, 180]. У 72 – 75% больных раком с мультицентрическим ростом опухоли обнаружено втяжение соска. В 54% сосок втягивался при медиальной локализации, в 60% – при центральном расположении опухолевого узла [106]. По мнению Л. Б. Голова (1996), Е. С. Герштейна, Н. Е. Кушлинского (1998), сосок в 40,3% поражается при дольковом раке молочной железы и в 50% при смешанном гистологическом типе. Чем выше степень злокачественности опухоли, тем выше вероятность поражения соска. Несмотря на множество работ, характеризующих данное заболевание, его дифференциальная диагностика трудна из-за неспецифичности проявления и отсутствия объективных данных современных визуальных методов исследования.
Внутрипротоковые папиллоыа(цистаденомы) нередко располагаются в субареолярной зоне, их развитие может привести к уплотнению стенок протока, подтягивающих сосок [22, 46, 132]. Уточнение диагноза без рентгенологических методик в данном случае невозможно.
Кисты, располагаясь в субареолярной зоне, также могут привести к втяжению соска молочной железы. W. D. Dupont et al. (1993), C. Friedenreich et al. (2000), G. Kontogeorgos et al. (1983) обратили особое внимание на слизистую метаплазию эпителия кист как на фактор, повышающий риск развития рака. С их точки зрения, при превалировании процесса фиброзирования образуются опухолеподобные узлы в виде очагового фиброза за счет увеличения бесклеточной гиалинизированной ткани, которые могут стать переходным звеном к неопластическим поражениям. Все это затрудняет диагностику и диктует необходимость при ее проведении использовать более объективные методы исследования [159, 167, 178].
Данных о втяжении соска при фиброаденомах в доступной литературе мы не встречали.
Гинекомастия– доброкачественное заболевание молочной железы у мужчин. Клинически гинекомастия проявляется в виде одно- или двусторонних уплотнений в позадисосковой области, не связанных с кожей, имеющих плотноэластическую консистенцию. Морфологически гинекомастия – не что иное, как фиброаденоматоз у женщин. Ткань молочной железы представлена множественными железистыми ходами, расположенными среди фиброзной ткани [116]. К втяжению соска может привести узловой тип гинекомастии, проявляющийся округлым, интенсивным затенением с ровными четкими контурами, локализующимся в позадисосковой области. По мнению В. П.Харченко, Н. И. Рожковой (2000), C. Haagensen(1956), локализация опухолевого образования имеет важное дифференциально-диагностическое значение, поскольку рак молочной железы у мужчин чаще располагается эксцентрично. Возможности и преимущества лучевых методов диагностики гинекомастии в доступной нам литературе не рассматриваются.
При узловом фибросклерозе (дисгормональном узловом пролиферате, локальной мастопатии) втяжение соска наблюдается у 15% женщин в возрасте 31– 50 лет. Сложность дифференциальной диагностики заключается в том, что нередко клинически, рентгенологически, сонографически, а порой и цитологически, узловая мастопатия имеет сходные проявления как с доброкачественными, так и со злокачественными заболеваниями молочной железы [3, 61, 70]. При динамическом наблюдении за больными с локальным фибросклерозом, расположенным близко к соску, в том числе и в рубцовом поле оперированной молочной железы, в 1,7% случаев наблюдается втяжение соска [106]. Для оценки состояния структуры молочной железы необходимо использовать объективные методы диагностики.
В литературе встречаются и описания редких заболеваний, приводящих к втяжению соска молочной железы. Так, Н. И. Пушкарев (1999) описал случай обнаружения личинки овода во втянутом соске молочной железы. Клинически отмечалось втяжение соска, имелись гиперемия ареолы и выделения из соска слизисто-гнойного характера, определялись болезненные аксиллярные лимфатические узлы. При сдавлении же соска молочной железы выделилась личинка белого цвета размером 1,2х0,3 см, что подтверждено паразитологическим исследованием.
З. М. Мурашова (1998) описала карциноид молочной железы при втянутом соске: клинически была выявлена опухоль диаметром около 4 см, плотной консистенции с неровными контурами, с фиксированной и утолщенной кожей в области соска, с признаками атипии по данным цитологического исследовании. В макропрепарате определялась жировая ткань и четко отграниченный узел – злокачественный карциноид молочной железы.
Болезнь Мондора(тромбоз поверхностных вен молочной железы) также может сопровождаться втяжением соска. На боковой стенке грудной клетки обнаруживается твердый тяж, сосок втягивается за счет воспалительных изменений окружающих тканей [26, 36, 65]. В работах Л. И. Гордеевой (1962), О. Поэску (1977) упоминается такая редкая патология, как синдром Шерешевского – Тернера, при котором наряду с хромосомными аномалиями отмечается втяжение соска и недоразвитие молочной железы.
Из перечисленного выше следует, что втяжение соска может встречаться при разных заболеваниях, но данные, свидетельствующие об этом немногочисленны, и основаны на клиническом обследовании.
Как утверждают Л. Д. Линденбратен (1997, 1999), Н. И. Рожкова (1993), И. Г. Щегорцова (1979), чувствительность и специфичность ф и з и к а л ь н о г о метода обследования соответственно составляют 61,4 и 51,2%. С развитием м а м м о г р а ф и и и других лучевых методов исследования возможности диагностики возросли. Например, чувствительность маммографии равняется 71–97% [177]. Ее использование увеличило способность распознавания рака молочной железы в доклинических стадиях до 80 – 92% [126, 136, 138]. Маммография также важна для выявления доброкачественных опухолей и предраковых состояний молочной железы [139, 140, 142, 150]. Правда, по данным Н. И. Рожковой (2000), S. Huberetal. (1998, 1999), информативность метода снижается при плотном фоне молочной железы, что в 1,8–6% случаев не исключает наличия рентгенонегативного рака, а в 20–30% – пропуск карцином в позадисосковой зоне.
Итак, оценивая рентгеновскую маммографию, ученые ничего не говорят об эффективности этого метода при синдроме втянутого соска молочной железы.
Для повышения информативности рентгенологического обследования в диагностике заболеваний молочных желез используют специальные методики искусственного контрастирования: пневмокистографию и дуктографию [71, 72, 152]. Последняя в 92–96% случаев позволяет установить причину патологической секреции, однако втяжение соска затрудняет проведение исследования.
Ультразвуковое исследование молочных желез(УЗИ) занимает ведущее место среди неионизирующих методов диагностики заболеваний молочных желез [37, 38, 39, 95, 96, 98, 112 123, 153, 162, 164, 171, 181]. Точность УЗИ в выявлении рака молочной железы колеблется по данным различных авторов от 78 до 94% в зависимости от размеров узла. Чувствительность УЗИ при узловых образованиях молочных желез составляет 71–84%, специфичность – от 65 до 97% [15, 18, 32, 44, 55, 85, 128].
УЗИ имеет преимущества в дифференциальной диагностике солидных и кистозных образований, обладая неинвазивностью, общедоступностью и отсутствием дозовой нагрузки, является одним из перспективных диагностических направлений [39, 67, 95, 96, 99]. Вместе с тем работ о возможностях ультразвуковой диагностики при заболеваниях, обусловленных втяжением соска, практически не встречается.
Большинство авторов, в том числе Л. Г. Корчевская (1993). Л. В. Якобс (1996), D. M. Hеnsell(1998), убеждены в том, что для получения более полной картины отображения выявленных изменений необходимо применять различные методы обследования. Они указывают, что при комплексном обследовании 265 больных РМЖ был выявлен у 97, доброкачественные опухоли – у 168, при этом точность диагностики достигала 97,7%.
В последние годы все большее значение придается цветовому
дуплексному картированию (ЦДК) с одновременным получением изображения интересующего объекта и сосудистой сети. Вместе с тем. Н. А. Смирнова (1995), Е.Ю. Трофимова (1999, 2000), J. A. Baker, M. S. Soo(2000), C. Peters-Engletal. (1995) отмечают отсутствие васкуляризации исследуемого узла в 85–95% наблюдений и считают, что регистрируемые сосуды в опухоли выявляются лишь при ее размере более 2 см, что свидетельствует о выраженной пролиферации клеточных структур.
ЦДК, по мнению Н. А. Смирновой (1995); J. S. Walshetal. (1994) повышает эффективность существующего диагностического комплекса, включающего маммографию, УЗИ, пункционную биопсию с 93 до 98 %. Каждый из методов обладает различной информационной ценностью: клиническое обследование – 50–68 %, рентгенологическое и цитологическое исследования – 87–92 %. Применение всех методов в комплексе дает возможность правильно диагностировать различные заболевания молочной железы в 95–97 % наблюдений [60, 116, 118].
Большое значение для дооперационной дифференциальной диагностики имеют новейшие технологии интервенционной радиологии, позволяющие одновременно осуществить высокоэффективную диагностику и щадящее лечение без объемного хирургического вмешательства [72, 77, 106, 154, 155]. Как утверждают В. В. Семиглазов (2001), И. М. Фролов (2000), D. M. Hеnselletal. (1988), эти технологии несложны в исполнении, малотравматичны, высокоинформативны, их чувствительность и специфичность составляют от 60 до 98 % в зависимости от проявления заболевания и структуры молочной железы. Так, для повышения надежности и точности аспирационной биопсии в последние годы используют стереотаксические приставки и систему «пистолет – игла» [13, 104, 106]. Однако ни в одной из доступных нам работ не отмечено методологических особенностей диагностики заболеваний, приводящих к втяжению соска.
Один из наиболее современных и перспективных методов диагностики – фиброоптическая дуктоскопия (ДС). С ее помощью можно решить ряд диагностических проблем при наличии внутрипротоковых папиллом (ВПП) у пациенток с втяжением соска. AkiraOkazakietal. (1991) получили первые результаты клинического применения фиброоптических дуктоскопий молочной железы. Например, из 46 больных с выделениями из соска у 4 был выявлен РМЖ, у 8 – папиллома, у 1 – воспалительные изменения. Правда, невозможность изучения глубоких отделов системы протоков ограничивает применение метода.
Наряду с описанными методами исследования, многие авторы указывают на использование таких методов диагностики, как лазерная маммография, мультислайсная компьютерная томография молочных желез с контрастным внутривенным усилением, трехмерная ультрасонография, гармонизация, панорамная сонография для планирования хирургического лечения, магнитно-резонансная томография, различные методики аспирационной биопсии под рентгенологическим и ультразвуковым контролем, радионуклидная диагностика, исследование онкомаркеров при раке молочной железы, чрезгрудинная флебография при метастазировании рака молочной железы в парастернальные лимфатические узлы [19, 24, 28, 30, 53, 78, 82, 86, 87, 91, 93, 96, 97, 99. 101, 105, 113, 131, 148. 156, 177, 181]. Однако серьезной дополнительной информации о природе заболеваний, сопровождающихся синдромом втянутого соска, они не дают.
Развитие маммографии, расширившей возможности выявления малых непальпируемых образований молочной железы, позволило проводить уточняющую диагностику на дооперационном этапе. По мнению А. В. Важенина с соавт. (2005), О. В. Ноговициной с соавт. (1998), W. K. Moonetal. (2000), лечебная тактика существенно варьирует в зависимости от характера процесса.
Вместе с тем остается неясным выбор наиболее приоритетной методики уточняющей диагностики при заболеваниях молочной железы, сопровождающихся синдромом втянутого соска, что требует дальнейших исследований. Определение чувствительности, специфичности и точности различных методов диагностики при синдроме втянутого соска является предметом дальнейших научных разработок.
Несмотря на появление новых методов уточняющей диагностики, втяжение соска молочной железы традиционно остается объектом хирургического вмешательства. Показания к операции, которыми руководствуются хирурги, были определены несколько десятилетий назад и основывались только на результатах клинического обследования. По сути, они отражают существовавший в то время весьма ограниченный уровень возможностей диагностики пальпируемых уплотнений в молочной железе [50, 167]. На наш взгляд, эта позиция устарела и нуждается в пересмотре.
Как показал анализ литературы, в вопросах диагностики заболеваний молочных желез наблюдается значительный прогресс. Однако на сегодняшний день нет четких сведений о причинах втяжения соска, о преимуществах того или иного метода диагностики, об их комплексном использовании в дифференциальной диагностике и расчете диагностической эффективности, об оптимальных ритмах контрольных обследований и алгоритме наблюдения, о показаниях к хирургическому лечению. Не разработаны симптомокомплексы, специфичные для различных заболеваний, формирующих синдром втянутого соска. Ни одна работа не касается проблемы вероятности развития рака молочной железы после перенесенных воспалительных процессов. Отсутствие же подобной информации приводит к тактическим и диагностическим ошибкам.
В связи с изложенным выше мы сделали попытку решить ряд задач, направленных на повышение эффективности диагностики при синдроме втянутого соска с использованием арсенала современных диагностических методов.
Проекции применяемые при маммографии
- Медиолатеральная косая;
- Краниокаудальная;
- Увеличенная краниокаудальная латеральная проекция;
- Латеромедиальная боковая;
- Каудокраниальная;
- Аксилярная;
- Тангенциальная;
- Латеромедиальная косая;
Медиолатеральный снимок используется для скриннинговой маммографии и является проекцией, которая позволяет получить изображение практически всех тканей молочной железы. Эта проекция обеспечивает полное отображение верхне-наружного квадранта молочной железы, где рак встречается чаще всего. Угол наклона меняется от 40 до 65 градусов, в зависимости от телосложения пациента (в среднем 45-55 градусов).
Критерии правильности укладки:
- Грудная мышца должна отображаться в косой проекции сверху и должна быть видима до уровня соска и ниже. Форма мышцы должна быть изображена слабо выпуклой как свидетельство того, что она совершенно расслаблена;
- Компрессия должна быть равномерной по всей площади железы;
- Сосок должен быть изображен в профиль;
- Должна быть видима небольшая желудочная складка, что свидетельствует о том, что представлена вся грудь.
Краниокаудальная проекция
Проекция обеспечивает визуализацию ткани молочной железы в плоскости отличной от медиолатеральной косой. Назначение этой проекции – получить снимок медиальных, центральных, субареолярных и латеральных структур молочной железы.
Критерии правильности укладки:
- Должна быть изображена вся паренхима молочной железы;
- Жировые ткани, находящиеся в близости к грудной мышцы, должны наблюдаться на снимке в виде темной полосы, а за ней должна быть видна грудная мышца;
- Сосок должен быть виден в профиль;
- Особое внимание следует обращать на то, чтобы не допустить складок на боковых частях груди.
Латеромедиальная проекция
Назначение этой проекции следующее:
- Выявить точное положение опухоли относительно соска (медиолатеральная косая не имеет такой возможности, т.к. трубка находится под углом).
- Выявить патологию, находящуюся в задней средней части молочной железы.
Боковая проекция
Критерии правильности укладки:
- Грудная мышца должна быть показана в виде узкой светлой полосы, по меньшей мере до половины изображения;
- Сосок должен быть изображен в профиль;
- Под грудью должна наблюдаться четкая желудочковая складка.
Увеличенная краниокаудальная латеральная проекция
Эта проекция используется для получения изображения тканей, находящейся в самой дальней латеральной части.
Тангенциальная проекция
Данная проекция используется для изображения пальпируемых масс; она дает изображение опухоли на фоне рентгенпрозрачной жировой клетчатки. Используется также для верификации обызвествлений в коже.
Каудокраниальная проекция
Проекция противоположна кранио-каудальной. Она используется для визуализации масс, находящихся в верхней части молочной железы, а также в случае, если пациенты страдают кифозом.
Латеромедиальная косая проекция
Противоположна медиолатеральной проекции. Используется в тех случаях, когда не может быть произведена стандартная медиолатеральная проекция из-за особенностей строения тела пациента (килевидная грудь)или других причин; когда нельзя добиться сжатия верхнемедиальной части молочной железы (катетеры, кардиостимуляторы, выступающие над поверхностью кожи, операции на открытом сердце, выполненные незадолго до маммографии).
Прицельная маммограмма
Производится с увеличением или без увеличения по следующей методике:
1) выбирается снимок, на котором зона интереса видна лучше всего;
2) используя сосок как начальную точку для измерения, определяем:
- как далеко от соска находится зона интереса;
- как далеко латеральнее соска находится зона интереса или насколько выше/ниже соска находится эта зона;
- как далеко зона интереса от кожи;
локализуется область интереса на коже пациента;
устройство для сжатия помещается над зоной интереса;
производится снимок.
Компрессия
Правильная компрессия необходима для:
- Уменьшения поглощенной дозы путем сокращения толщины ткани молочной железы;
- Уменьшения рассеяния;
- Уменьшения нерезкости путем сокращения расстояния «объект-пленка»;
- Уменьшения нерезкости вызванной движением;
- Обеспечения однородной плотности снимка;
- Выявления различий между нормальной тканью и опухолью.
Сжатие должно быть плотным, но не болезненным.
Возможности соноэластографии в уточняющей диагностике злокачественных заболеваний молочной железы.
Рожкова Н.И.¹, Зубарев А.В.², Шерстнева Т.В.¹, Хохлова Е.А³.
¹ ФГУ «Российский научный центр рентгенорадиологии» Минздравсоцразвития РФ Федеральный маммологический центр Минздравсоцразвития РФ», г. Москва.
² ФГУ «Учебно-научный медицинский центр» Управления делами Президента РФг. Москва..
³ФГУ «Поликлиника №1» Управления делами Президента РФг. Москва.
Введение
Рак молочной железы (РМЖ) занимает лидирующие позиции среди злокачественных опухолей и в последнее десятилетие прочно занимает первое место в структуре онкологической заболеваемости и смертности женщин в России [2,5,6,7,9].
В настоящее время РМЖ составляет 20,9% от всех злокачественных новообразований у женщин. По сравнению с 2002 годом прирост заболеваемости составил 13,1% [2]. Продолжается и рост смертности от этого грозного заболевания. У женщин основной причиной смерти от злокачественных опухолей в возрасте 40-69 лет является РМЖ, который составляет 17,3% [2].
Таким образом, выявление заболеваний молочной железы (МЖ), в том числе рака, является первостепенной задачей [1,5,6].
В диагностике заболеваний МЖ особое значение имеют методы лучевой визуализации: рентгеновская маммография (МГ) и ультразвуковое исследование (УЗИ), реже – магнитно-резонансная томография, а также комплекс методик интервенционной радиологии для морфологической верификации выявленных патологических изменений. Современное исследование МЖ предполагает комплексное применение различных методов в оптимальном сочетании и последовательности. Так, для распознавания локального фиброза, рака, сгруппированных микрокальцинатов предпочтительна рентгеновская МГ; для распознавания кист, фиброаденом, липом лучше использовать УЗИ [9].
Но, тем не менее, остается нерешенной проблема дифференциальной диагностики доброкачественных и злокачественных заболеваний МЖ при сходной или «смазанной» клинической, рентгенологической и сонографической картине.
Это обстоятельство требует не только совершенствования традиционных диагностических методов, сильные и слабые стороны которых хорошо изучены, но и продолжения поиска дополнительных уточняющих технологий, способных поставить уровень диагностики заболеваний МЖ на качественно новую ступень.
В последнее время активно разрабатывается новое направление визуализации сдвиговых упругих характеристик биологических тканей – так называемый метод эластографии (ЭГ). Он дополняет традиционные методы визуализации неоднородностей тканей и считается перспективным для диагностики патологии различной локализации [4,22,24,28].
Механические свойства биологических мягких тканей давно служат врачам важным источником информации о состоянии этих тканей и связанных с ними физиологических систем [3,10]. Различные патологические процессы вызывают значительные изменения в структуре ткани, модифицируя её свойства и приводя к локальному увеличению плотности и снижению способности деформироваться при компрессии. Несмотря на значительный технический прогресс в области усовершенствования методов диагностики заболеваний МЖ, на первом месте в комплексе, по-прежнему, остается клиническое обследование, включающее пальпацию МЖ и регионарных зон лимфооттока [1,5]. Пальпация на начальных этапах обследования нередко позволяет выявить патологические изменения в мягких тканях. Однако метод очень субъективен, а при небольших размерах образований или при их глубоком расположении вообще не информативен. Возможности УЗИ в диагностике очаговой патологии МЖ, в особенности ранних форм РМЖ, несопоставимо выше [26]. Внедрение новой УЗ технологии - эластографии в значительной степени позволяют объективизировать и детализировать данные о плотности и эластичности ткани.
В процессе эластографии (ЭГ) на исследуемую ткань накладывают дополнительное давление. Из-за неодинаковой эластичности, неоднородные элементы ткани смещаются по-разному, что изменяет в свою очередь отраженный ультразвуковой сигнал. Эластичность тканей на экране ультразвукового сканера отображается определенными цветами. Более плотные структуры тканей окрашиваются оттенками синего цвета. Легкосжимаемые эластичные участки маркируются красной цветовой шкалой, участки с промежуточной степенью эластичности окрашиваются зеленым цветом. Таким образом, ЭГ дает дополнительную возможность для проведения дифференциальной диагностики патологии мягких биологических тканей [17].
В публикациях зарубежных авторов за последние десять лет довольно противоречиво оценивается информативность данного метода, что связано с отсутствием стандартизированных подходов к эластографическому исследованию МЖ и единых дифференциально-диагностических критериев [12,15,16,21,23]. В целом, авторы единодушны во мнении, что метод нуждается в дальнейшем изучении. Отечественные публикации по данной теме практически отсутствуют. В связи с этим, целью настоящего исследования явилось определение возможностей ультразвуковой эластографии в диагностике злокачественных заболеваний МЖ.
Материалы и методы исследования
Обследовано 276 пациентов (306 наблюдений) в возрасте от 18 до 92 лет (средний возраст составил 45,5±7,51 лет) с патологией МЖ. В 89 (29%) наблюдениях были выявлены злокачественные заболевания МЖ, в 217 (71%) – доброкачественные заболевания, полный перечень которых представлен в таблице 1.
Таблица 1. Распределение больных с доброкачественными и злокачественными заболеваниями молочной железы в зависимости от их нозологической формы (n= 306)
Злокачественные заболевания
Количество наблюдений
Доброкачественные заболевания
Количество наблюдений
абс.ч
%
абс.ч
%
Инфильтрирующий протоковый рак
52
17
Узловая мастопатия (склерозирующий аденоз, локальный фиброз, рубец Semb’a)
47
15,4
Инфильтрирующий дольковый рак
12
3,9
Киста
45
14,7
Инфильтрирующий протоково-дольковый рак
3
1
Фиброаденома
77
25,2
Внутрипротоковый рак in situ
6
2
Доброкачественная
листовидная опухоль
3
1
Папиллярный рак
5
1,6
Внутрипротоковая папиллома
10
3,3
Медуллярный рак
1
0,3
Мастит
10
3,3
В-клеточная лимфома
2
0,6
Прочие доброкачественные образования¹
25
8,1
Неустановленные гистологические формы рака
8
2,6
Всего
89
29%
Всего
217
71%
Примечания: ¹Прочие доброкачественные заболевания: атерома, липома, олеогранулема, цистаденопапиллома, гинекомастия, галактоцеле.
Больные были обследованы на базе Федерального Маммологического центра Минздравсоцразвития РФ (ФГУ «Российский научный центр рентгенорадиологии» Минздравсоцразвития России), а также кафедры лучевой диагностики (ФГУ «Учебно-научный медицинский центр Управления делами Президента РФ).
Среди больных преобладали женщины – 270 из 276 (98%), тогда как мужчин было только 6 (2%).
Возраст больных РМЖ колебался от 36 до 92 лет (средний возраст - 54,8 ± 1,2 года). При этом РМЖ чаще встречался у лиц от 40 до 59 лет (67% среди всех заболевших раком).
При РМЖ были выполнены следующие хирургические вмешательства: квадрантэктомия с подмышечной лимфаденэктомией – у 16 (26%) больных (в т.ч. в 1 случае в сочетании с одномоментной пластикой торакодорсальным лоскутом и имплантом), ампутация молочной железы с подмышечной лимфаденэктомией – у 4 (6,5%), мастэктомия по Маддену – у 41 (66%), секторальная резекция – у 1 (1,5%).. У 25 (28,4%) пациентов операции предшествовала химиотерапия и/или лучевая терапия. У 26 (29,5%) больных с РМЖ хирургическое лечение проводилось в других лечебных учреждениях либо не применялось в связи с запущенностью опухолевого процесса.
Распространенность опухолевого процесса при РМЖ, классифицированная по системе TNM, была следующая: Tis– 6 (6,8%), Т1N0M0 – 17 (19,3%), T1N1M0 – 6 (6,8%), T1N2M0 – 2 (2,3%), T1N3M0 – 1 (1,1%), T2N0M0 – 23 (26,1%), T2N1M0 – 10 (11,4%), T2N2M0 – 3 (3,4%), T3N1M0 – 3 (3,4%), T3N1M1 – 1 (1,1%), T4NM– 8 (9,1%). У 8 (9,1%) больных стадия заболевания осталась не уточненной. У 1 пациентки (1,1%) выявлена В-клеточная лимфома 4 стадии с поражением ЛУ, МЖ, мягких тканей и орбиты левого глаза. Размеры злокачественных образований варьировали от 0,3см до 6,0см: 0,3-1,0см – 24 наблюдения (27%), 1,1-2,0см – 43 (48,3%), 2,1-3см – 15 (16,8%), более 3,1см – 7 (7,9%).
В стандартный комплекс обследования входило клиническое обследование (сбор анамнеза, осмотр, пальпация молочных желез и регионарных лимфатических узлов), рентгеновская маммография, ультразвуковое исследование, комплекс технологий интервенционной радиологии и последующая морфологическая верификация.
Рентгенологическое исследование проводилось на современном маммографе «SenographeEssential» фирмы «GE», снабженным всеми современными техническими средствами, позволяющими обеспечить высокое качество снимка в условиях низких дозовых нагрузок.
Стандартное УЗИ, ультразвуковая ангиография (УЗА), а также оценка эластичности выявленных изменений были выполнены на современных ультразвуковых аппаратах «HitachiHiVision900» и «HitachiHiVision6500» (HITACHI, Япония), работающих в режиме "реального времени", с использованием мультичастотных линейных датчиков с частотой 7,5-13 MНz, оснащенных программным обеспечением для соноэластографии.
Эластографическое изображение реализовалось при минимальной компрессии стандартным ультразвуковым датчиком исследуемой области в виде цветового картирования эластичности в выбранной зоне. Две секции экрана сканера представляли стандартный В-режим и соноэластографическую интерпретацию. Эластичность тканей определялась и отображалась определенными цветами на обычном экране В-режима.
Для оценки эффективности соноэластографии были выделены качественные и количественные диагностические критерии. Качественная оценка заключалась в анализе распределения эластичности тканей молочной железы, к количественным критериям относился коэффициент деформации, то есть степень деформации образования молочной железы по сравнению с неизмененными окружающими тканями.
Первоначально производилась оценка образования в стандартном В-режиме. После активации методики эластографии выбиралась зона интереса в зависимости от размера и положения образования. Для получения стабильной соноэластограммы зону интереса следует устанавливать в том месте, где смещение тканей и ход ультразвуковых лучей совпадают по направлению. Компрессия датчиком должна быть минимальной. При этом не должна возникать деформация молочной железы. Увеличение компрессии может привести к получению ложноотрицательных результатов.
В зависимости от степени плотности образования и инфильтрации окружающих тканей эластографические изображения классифицируются следующим образом (рис.1) [16,19].
Рис.1. Классификация эластографических изображений.
Первые три типа эластограмм относятся к доброкачественным образованиям (рис. 1а,1б,1в), четвертый и пятый типы – к злокачественным (рис. 1г,1д). Нами получено еще два типа изображения: трехслойный тип – характерный для жидкостьсодержащих структур и мозаичный тип с участками зеленого и красного цвета (рис. 1е, 1ж).
Режим эластографии обладает возможностью не только получения изображений, несущих важное диагностическое значение, но и количественного анализа степени деформации тканей (StrainRatio). Для определения коэффициента деформации (КД) на статической эластограмме первоначально вручную выделялась область по внутреннему контуру исследуемого образования. Затем выбиралась идентичная по размерам область в жировой ткани. Коэффициент деформации рассчитывался автоматически с помощью программного обеспечения ультразвукового сканера. Данное измерение являлось не абсолютной, а относительной сравнительной величиной и показывало во сколько раз образование плотнее, чем жировая ткань.
Для достижения поставленной цели был оптимизирован методический подход к исследованию эластичности тканей МЖ. Последовательное проведение следующих трех этапов обеспечивало максимальную диагностическую информацию при минимальных затратах времени:
Для морфологического подтверждения природы патологических изменений применялись различные методики интервенционной радиологии. В их числе для получения клеточного материала проводилась тонкоигольная аспирационная биопсия: в 91 (29,7%) наблюдении (при РМЖ – 8,8%, при доброкачественных образованиях – 91,2%). Для получения клеточного и тканевого материала выполнялась аспирационная биопсия системой «пистолет-игла»: в 115 (37,6%) случаях (при РМЖ – 69,6%, при доброкачественных заболеваниях – 30,4%). В зависимости от визуализации изменений процедуры выполнялись у 180 (87,4%) больных под контролем УЗИ, у 26 (12,6%) – под контролем рентгенографии. 7 (2,3%) пациенткам проведена вакуумная аспирационная биопсия, из которых 6 (85,7%) больным – с лечебным эффектом в целях удаления фиброаденомы МЖ под контролем УЗИ и 1 (14,3%) под рентгенографическим контролем с целью верификации диагноза при локальном скоплении микрокальцинатов. В 93 (30,4%) случаях доброкачественных образований МЖ биопсия не проводилась, заключение основывалось на данных динамического наблюдения.
При статистической обработке результатов исследования оценивались критерии оценки информативности метода: чувствительность, специфичность, прогностичность отрицательного результата, прогностичность положительного результата, точность метода, производился сравнительный анализ различных диагностических методов.
Достоверность количественных различий между изучаемыми методами определялась с помощью параметрического t- критерия Стьюдента. Достоверным считалось общепринятое в медицинских исследованиях значение p< 0,05.
Результаты исследования и обсуждение
При клиническом обследовании 276 пациентов у 88 (87 женщин и 1 мужчина) было выявлено 89 образований злокачественной природы, 68 (76,4%) из них пальпировались, 21 (23,6%) – не пальпировались. При осмотре МЖ втяжение соска определялось у 10% больных, отёк и гиперемия кожных покровов у 7%, втяжение кожных покровов у 12%.
В группе пациентов со злокачественными опухолями МЖ рентгеновская МГ была выполнена во всех случаях. У большинства больных рентгенологическим фоном являлась фиброзно-жировая инволюция – у 28 (31,5%) больных, у 18 (20%) – нерезко выраженная фиброзная мастопатия, у 15 (17%) – фиброзная мастопатия средней степени выраженности и также у 15 (17%) – выраженная фиброзная мастопатия, у 5 (5,5%) – выраженная диффузная мастопатия по типу аденоза.
В 67 (75,3%) из 89 наблюдений злокачественных образований на рентгенограмме был обнаружен опухолевый узел размерами от 0,5см до 5,5см, в 10 (11,2%) – лишь участки сгруппированных микрокальцинатов, в 9 (10,1%) – локальная перестройка структуры. В 3 (3,4%) случаях изменения на маммограмме не определялись.
В 56 (83,6%) случаях из 67 при наличии узлового образования были отмечены типичные рентгенологические признаки рака: нечеткие или лучистые контуры узла, скопления микрокальцинатов в опухоли. У 11 (16,4%) больных узел имел четкие контуры.
По данным традиционного ультразвукового исследования (В-режим) в 90% случаев образования имели характерные признаки злокачественного процесса: размытость контуров за счет инфильтрации окружающих тканей, сниженная эхогенность образования, неоднородная внутренняя эхоструктура, наличие акустической тени.
При анализе допплерометрических характеристик опухолевых сосудов была отмечена большая их вариабельность. При использовании цветового допплеровского картирования (ЦДК) и более чувствительного энергетического картирования (ЭК) кровоток был выявлен в 77% случаев, из них признаки патологического кровотока при узловой форме рака выявлялись лишь в 55%. Отмечалась деформация сосудистого рисунка, различный калибр сосудов, патологическое их ветвление. У 36% больных в режиме ИД были выявлены сосуды с допплерографическими характеристиками патологического спектра кровотока в виде артерио-венозных шунтов, высоких систолических составляющих, деформированных пиков, а также отсутствия диастолической составляющей. В остальных случаях определялись сосуды с нормальными спектральными характеристиками. Показатель средней систолической скорости у пациентов со злокачественными опухолями составил 16,2±1,5 см/сек, IR0,75±0,02.
Результаты ЭГ у больных РМЖ (табл. 2) в корне отличались от результатов у пациентов с доброкачественными образованиями за счет более высокой плотности узлов и инфильтрации окружающих тканей (рис. 2).
Рис.2 Частота выявления эластографических типов у больных с доброкачественными и злокачественными заболеваниями МЖ.
Примечание: *, ** - достоверность различий между группами по показателю соответственно р<0,002 и р<0,001; н.д. – различия не достоверны.
При злокачественных образованиях в 78,6% (в 70 случаях из 89) определялся четвертый и пятый тип эластограммы. В то время как, при доброкачественных заболеваниях в 94,5% (в 205 случаях из 217) определялся первый, второй, третий, шестой и седьмой тип эластограммы.
Таблица 2. Частота эластографических признаков, выявленных при злокачественных образованиях МЖ различного гистологического строения (n=89)
Гистологическая форма
Количество наблюдений, абс.ч. (%)
Коэффициент деформации,
М(КД)±m
2 тип
3 тип
4 тип
5 тип
инф. протоковый рак (n=52)
7 (13,5%)
4 (7,5%)
13 (25%)
28 (54%)
23,07±2,8
инф. дольковый рак (n=12)
1(8,5%)
-
1(8,5%)
10(83%)
38,62±9,8
инф. протоково-дольковый рак (n=3)
1(33%)
-
-
2(67%)
15,28±2,9
внутрипротоковый рак(n=6)
2(33%)
-
-
4(67%)
4,3±0,67
папиллярный рак
(n=5)
1(20%)
-
3(60%)
1(20%)
19,72±14,3
медуллярный рак
(n=1)
-
-
1(100%)
-
4,36
лимфома
(n=2)
2 (100%)
-
-
-
7,4
неустановленные гистологические формы рака
(n=8)
1(12,5%)
-
2(25%)
5(62,5%)
23,3±11,7
Итак, рассмотрим типы эластограммы, характерные для злокачественных образований.
При четвертом типе эластограммы образование имело отображение в виде гомогенного плотного узла, окружающие ткани сохраняли нормальные параметры эластичности. Данный тип достоверно чаще был характерен для солидных, отграниченных карцином (р<0,001).
В ряде случаев дифференциальный диагноз доброкачественных опухолей и отграниченных карцином затруднен. В нашем исследовании, у 1 пациентки с медуллярным раком и у 2 больных с папиллярным раком (без жидкостного компонента) рентгенологические и сонографические проявления симулировали наличие фиброаденомы. В этих наблюдениях выявление четвертого типа эластограммы с высоким значением КД (5,6±1,1) послужило важным критерием для проведения дифференциальной диагностики (рис. 3).
Рис.3 Папиллярный рак правой молочной железы: А – маммограмма: образование с ровными контурами (обозначено стрелками); Б – режим ЭК: сосуды в образовании имеют прямолинейный ход; В – эластограмма: четвертый тип картирования.
Пятый типбыл выявлен только при РМЖ (в 50 наблюдениях), при этом образование и окружающие ткани обладали высокой плотностью, что отражало инфильтрацию раковыми клетками интерстициального пространства (опухоли со скиррозным типом роста), а также внутрипротоковое распространение опухолевых клеток при раке insitu. Выявление пятого типа картирования являлось достоверным признаком злокачественной опухоли (р<0,001). КД во всех случаях имел высокие значения, варьировал от 4,8 до 102,1 (в среднем – 31,19±3,1) (рис.4).
Рис.4 Инфильтрирующий протоковый рак левой молочной железы: А – на маммограмме определяется узел с нечеткими лучистыми контурами; Б – при эластографии выявлен пятый тип, коэффициент деформации 7,38; В – гистологический препарат.
Также при РМЖ был выявлен второй и третий тип эластограммы.
Особенно большие затруднения в трактовке природы изменений представлял второй тип эластограммы, когда образование было несколько плотнее, чем окружающие ткани и характеризовалось сочетанием зон повышенной и средней жесткости. Данный тип выявлялся как при доброкачественных (46,5%), так и при злокачественных образованиях (16,8%). Однако достоверно чаще второй тип определялся при доброкачественных процессах в МЖ (р<0,001). Ложноотрицательные результаты были получены в 15 (16,8%) случаях. Нами было отмечено, что в 12 (80%) из 15 наблюдений размеры опухоли были свыше 2,0см (рис.5).
Рис.5 Рак добавочной доли правой молочной железы: А – эластограмма: второй тип картирования (образование занимает около ½ зоны интереса); Б – сонограмма: гипоэхогенное образование с нечеткими контурами, размерами 2,2х2,6см.
Размеры злокачественных образований играли важную роль, поскольку эластограмма даёт информацию о сравнительной плотности тканей, включённых в зону интереса. В связи с этим целесообразно включать в зону интереса неизмененные окружающие ткани для правильного распределения различий в плотности образования и окружающих тканей. Для правильной интерпретации полученных эластографических изображений образование должно занимать около четверти зоны интереса, но в случае образования более 2,5см соблюдение данного правила невозможно.
В 2 (13,3%) ложноотрицательных наблюдениях при гистологическом исследовании был выявлен внутрипротоковый рак, который обладал меньшей плотностью в сравнении с инфильтрирующим раком, что было выявлено в исследованиях эластичности образцов различных тканей МЖ invitro[18].
Несмотря на несоответствие качественной эластографической картины окончательному диагнозу, КД в 5 из 15 ошибочных наблюдений был выше 4,3. Также были выявлены рентгенологические и ультразвуковые признаки злокачественного процесса, при которых применение дополнительных диагностических методик не столь необходимо.
Центральная часть образования третьего типа картировалась синим цветом, периферические отделы – зеленым. По данным литературы, возникновение подобного типа картирования до сих пор остается неясным [16]. Третий тип был обнаружен в 20 (9,2%) наблюдениях доброкачественных образований и в 4 (4,5%) злокачественных, причем различия по двум группам были не достоверны (р>0,05). КД при РМЖ лишь в 1 случае из 4 превышал 4,3 и составил 23,42. При доброкачественных образованиях в 19 из 20 наблюдений КД имел значения ниже 4,3 и варьировал от 2,1 до 4,15 (в среднем – 2,7±0,14). Это позволило сделать вывод о том, что в случае выявления третьего типа эластограммы качественный критерий ЭГ не гарантирует достоверности суждения о характере выявленных изменений, тогда как использование количественного критерия в 83,3% случаев позволяет сделать правильное заключение.
При анализе результатов количественной оценки эластографических данных с помощью коэффициента деформации установлено, что достоверным признаком злокачественного образования в МЖ являются высокие значения коэффициента (среднее значение КД 22,9±2,14), в отличие от доброкачественных образований (среднее значение КД 2,0±0,1) (р<0,001).
Данные соноэластографии соответствовали патоморфологическому заключению в 275 из 306 наблюдений. При оценке качественных соноэластографических критериев чувствительность метода составила 78,6%, специфичность 94,5%, точность 89,9%, прогностичность положительного результата 85,4%, прогностичность отрицательного результата 91,5%. При оценке количественных соноэластографических критериев чувствительность метода составила 83,1%, специфичность 94%, точность 90,8%, ППТ 85%, ОПТ 93,1%. Таким образом, подключение количественного критерия ЭГ увеличивало чувствительность метода на 4,5%.
Сравнительная информативность лучевых методов при дифференциальной диагностике заболеваний МЖ, визуализирующихся при всех методах исследования, приведена на рис. 6.
Рис.6 Сравнительная информативность МГ, УЗИ, УЗА и ЭГ.
Различия по чувствительности, специфичности и точности УЗИ и МГ были не достоверны (р>0,05). Однако важно отметить, что информативность лучевых методов исследования МЖ в отношении различных нозологических форм значительно отличается. Более высокая информативность рентгеновской МГ отмечается в распознавании рака, в особенности его непальпируемых форм в виде скопления микрокальцинатов и тяжистой перестройки структуры, а также локального фибросклероза. При этом метод рентгеновской МГ имеет достаточно высокую чувствительность, но недостаточную специфичность. УЗИ имело преимущества при наличии плотного фона (преобладание железистой ткани) и при дифференциации кистозных и солидных структур.
На основании серошкальной эхографии характер изменений был правильно интерпретирован в 245 (80%) из 306 наблюдений. В 52 (17%) случаях зафиксированы ложноположительные заключения о злокачественном характере процесса в МЖ. Именно в этих наблюдениях полезным оказалось применение дополнительных ультразвуковых технологий, таких как УЗА и ЭГ. При этом количество ложноположительных заключений о характере процесса сократилось при использовании УЗА на 3,6 %, при ЭГ – на 13%. Таким образом, при сочетании стандартного УЗИ с дополнительными УЗ технологиями (УЗА, ЭГ) был правильно интерпретирован характер патологических изменений в 93%, что позволило повысить информативность стандартного УЗИ на 13%.
Сопоставление результатов изучения эластичности ткани МЖ с данными клинико-рентгенологического и традиционного ультразвукового исследований, показало, что специфичность (94,5%) и положительный предсказательный тест (85,4%) ЭГ были достоверно выше по сравнению с МГ и УЗИ (р<0,001), при достаточно низкой чувствительности метода (78,6% при использовании качественного критерия и 83,1% – количественного). Данные показатели говорят о невозможности использования ЭГ на этапе скрининга и указывает на эффективное применение этого метода при дифференциальной диагностике исходно выявленных изменений в МЖ с помощью МГ и УЗИ. Наши данные подтверждают мнение Thomas[24,25] и Zhi[28] о том, что ЭГ более точно подтверждает доброкачественные образования МЖ, что может потенциально снизить количество инвазивных вмешательств в этих случаях.
Синдром непальпируемого образования в молочной железе объединяет скрыто протекающие заболевания, которые выявляют при скрининговом рентгенологическом исследовании или при УЗИ. Из литературы известно, что раннее выявление этих заболеваний улучшает прогноз [5].
Проблема выявления РМЖ в начальной стадии чрезвычайно актуальна, поскольку ранняя диагностика позволяет проводить вместо калечащих операций органосохраняющее лечение. Многочисленными работами было показано, что чем раньше выявляется опухоль, тем дольше продолжительность жизни пациентов. Так, 20-летняя продолжительность жизни пролеченных больных РМЖ 0 и 1 стадии достигает 92% [7,9]. В связи с этим, становится очевидным стремление ряда исследователей определить возможности ЭГ в диагностике непальпируемых образований МЖ [11-13,21]. По данным Choпри исследовании микрокальцинатов без видимого узла при МГ, имеющих отображение при УЗИ, была отмечена достаточная высокая чувствительность ЭГ – 97% и значение отрицательного предсказательного теста – 96% [12]. Локальное скопление микрокальцинатов на маммограмме, имеющее отображение при УЗИ в нашем исследовании было выявлено у 16 (5,2%) больных, из них у 10 (62,5%) - внутрипротоковый рак и рак в стадии T1N0M0, у 6 (37,5%) - очаговая форма склерозирующего аденоза. При раке данные ЭГ соответствовали результату морфологического исследования в 8 (80%) случаях (рис. 7), при склерозирующем аденозе – в 5 (83,3%).
Рис.7 Внутрипротоковый рак левой молочной железы: А – фрагмент маммограммы: локальное скопление микрокальцинатов; Б – эластограмма: четвертый тип картирования (размеры образования в В-режиме не превышают 4 мм).
В нашем исследовании также было выявлено, что чувствительность ЭГ возрастала в группе пациентов с диаметром образования 0,3-1,0см и 1,1-2,0см до 87,5-90,7% и достоверно снижалась до 28,6-53,3% в группе больных с образованиями диаметром более 2,1см (р<0,001). Получение корректных эластограмм в случае размеров образования более 2,5см было затруднительным, так как оно занимало большую часть зоны интереса, соответственно, методология проведения ЭГ нарушалась.
Сопоставление результатов ЭГ с данными традиционного УЗИ и УЗА, показало, что чувствительность ЭГ для непальпируемых опухолей составила 87,5%, чувствительность УЗИ – 66,7%, УЗА - лишь 57,1%.
Таким образом, ЭГ более информативна при оценке опухолей менее 2-2,5см в диаметре.
Определение лечебной тактики у больных РМЖ во многом зависит от стадии заболевания (Т). По данным литературы корреляция клинических размеров злокачественной опухоли при пальпации с данными морфологического исследования средняя – 0,68 [14]. Painс соавт. считают, что при клиническом осмотре происходит переоценка размеров мелких узлов опухоли и недооценка размеров крупных (более 5,0 см) узлов [20]. Коэффициент корреляции в определении размера выявленного узлового образования для маммографии составляет 0,82-0,84, при этом 50% опухолей в стадии Т1 переоценивались, а 11,1% опухолей в стадии Т2 были недооценены при МГ [27]. При оценке размера выявленного узла большинство авторов пришло к выводу, что эхография является наиболее точным методом диагностики [8,14,27]. Тем не менее, Painс соавт. отмечали, что при эхографии иногда возможна недооценка в определении границ опухоли [14].
Мы провели анализ оценки размера опухоли с инфильтрирующим ростом по максимальному значению в сравнении с данными морфологического исследования (табл. 3). Для этого была отобрана группа из 23 пациенток с пятым типом эластограммы, подвергшихся хирургическому лечению и оценке макроскопического препарата удаленной опухоли.
Таблица 3. Сравнительные значения размеров опухоли (см) по данным клинического, маммографического, ультразвукового, эластографического и визуального морфологического исследования у пациентов с инфильтрирующим раком МЖ (n=23)
Размеры
Пальпация
МГ
УЗИ
ЭГ
Морф. иссл.
Средний размер
2,4±0,17
1,7±0,14
1,24±0,15
1,63±0,15
1,60±0,16
Максимальный размер
4,0
3,0
3,0
3,3
3,5
Минимальный размер
1,5
0,5
0,4
0,6
0,7
Коэффициент корреляции
0,7
0,84
0,82
0,89
-
При анализе полученных данных оказалось, что пальпаторная оценка размера опухоли наименее точная, коэффициент корреляции не превышает 0,7. При оценке размеров опухоли по данным МГ отмечена переоценка опухоли преимущественно в стадии Т1, коэффициент корреляции составил 0,84. УЗИ характеризовалось недооценкой в определении границ опухоли, коэффициент корреляции составил 0,82. Ошибочная трактовка размера опухоли по данным сонографии была отмечена при распространении опухоли по протокам, при звездчатой форме узла и при выраженной акустической тени, определяющейся за узлом.
ЭГ при оценке размеров инфильтрирующих опухолей показала наивысшую корреляцию с морфологическим исследованием (коэффициент корреляции 0,89). При оценке размера опухоли точность в пределах 3 мм наблюдалась в 84% случаев.
Таким образом, ЭГ позволяет оценить размер опухоли с инфильтрирующим ростом с высокой степенью достоверности и может использоваться при уточнении стадии опухолевого процесса.
Соноэластография, как и другие методы исследования МЖ, имеет ряд ограничений. Во-первых, с помощью данной методики возможна оценка только тех очаговых изменений, которые имеют отображение при стандартном ультразвуковом исследовании. Скопление микрокальцинатов на площади до 1,5см, локальную тяжистую перестройку структуры и большинство новообразований внутри протока ультразвуковое исследование не выявляет, в связи с чем, УЗИ в сочетании с ЭГ нельзя применять в качестве скринингового метода. Во-вторых, ЭГ неинформативна при диффузных изменениях в МЖ вследствие изменения архитектоники всей железы (инфильтративно-отечная форма РМЖ без узлового образования, диффузная форма мастита). В-третьих, было отмечено, что для получения корректной эластограммы имеют значение размеры образования. ЭГ более информативна при образованиях менее 2,0 см в диаметре. Также ограничением применения метода явились ранние постлучевые изменения, приводящие к значительному увеличению плотности железы, что не позволяло применять лёгкую компрессию для получения адекватного эластографического изображения.
По результатам проведенного исследования были выработаны следующие показания к проведению ультразвуковой эластографии:
Выводы
Рак молочной железы.
http://www.e-radiography.net/articles/mammo/mammo_introduction.htm