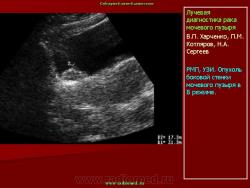
УЗИ мочевого пузыря.
Внутриполостное ультразвуковое исследование в диагностике рака мочевого пузыря и предстательной железы.
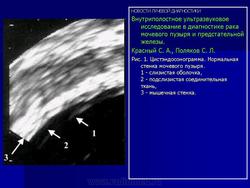
Красный С. А., Поляков С. Л.
НИИ онкологии и медицинской радиологии им. Н. Н. Александрова, г. Минск.
В течение длительного времени опухоли мочевого пузыря занимали ведущее место в структуре онкоурологических заболеваний, а больные раком мочевого пузыря составляли основной контингент онкоурологических отделений и амбулаторных приемов. В последние годы на первое место вышел рак предстательной железы (РПЖ), что связано не с уменьшением заболеваемости раком мочевого пузыря, а в большей степени со значительным ростом больных с опухолями простаты. В 2000 году заболеваемость раком предстательной железы составила 24,3 на 100 000 мужского населения, а заболеваемость раком мочевого пузыря в Республике Беларусь - 10,8 на 100 000 населения. В то время как в 1991 эти показатели были 10,2 и 7,7 на 100 000 населения.
Вопрос о классификации опухолей мочевого пузыря до настоящего времени нельзя считать окончательно решенным. При этом, если в отношении гистологических форм опухолей больших разногласий не существует и весь мир сегодня пользуется гистологической классификацией Mostofi (1974), то в отношении стадий заболевания по общепринятой системе TNM особенно среди клиницистов встречается много замечаний, что приводит к периодической ее коррекции и обсуждениям. Это связано с тем, что они хотели бы иметь такую классификацию, которая позволяла бы с одной стороны достаточно просто определять стадии процесса, с другой - чтобы эти стадии хорошо коррелировали с прогнозом заболевания, давая четкое представление о динамике роста, метастазирования и прогностическом потенциале конкретной опухоли у конкретного больного. В оптимальном варианте стадия процесса должна определять и лечебную тактику у данного больного. В настоящее время онкоурологи пользуются международной классификацией по системе TNM 4-го издания 1987 г в редакции 1997 г, которая основана на данных о глубине инвазии стенки мочевого пузыря опухолью. Большим недостатком этой классификации является то, что на дооперационном этапе не существует достаточно надежных методов определения степени инвазии стенки мочевого пузыря.
Методы, традиционно применяющиеся в урологических клиниках для постановки диагноза рака мочевого пузыря и определения его локализации (цистоскопия, эндовезикальная биопсия, рентгеноконтрастные методы изучения мочевой системы), не позволяют получить информацию о степени местного распространения опухоли [1, 9, 10]. Так, при клинико-инструментальном обследовании больных, включающем в себя бимануальную пальпацию, внутривенную урографию и цистоскопию, количество ошибок при дооперационном определении стадии РМП, колеблется, по данным различных авторов, от 40 до 80% [2, 14]. По данным D.Skinner, приблизительно в 40% случаев стадия клинически недооценивается, в около 20% - переоценивается, и только менее, чем в 40% совпадает с патологоанатомической. Чаще всего ошибки наблюдаются в стадии Т2 (75%). Определить степень прорастания слоев мочевого пузыря может только патоморфолог при исследовании удаленного препарата. Клинически невозможно отличить стадию Та от Т1 и Т2a от Т2b.
Представляется гораздо более важным для определения тактики лечения больного различать опухоли, не врастающие в мышечный слой (поверхностные) и прорастающие в детрузор и глубже (инвазивные). Это имеет принципиальное значение, так как при поверхностных опухолях (т. е. в стадиях Тis, Ta и T1) метастазы в лимфоузлах встречаются крайне редко, в то время как при инвазии в мышечный слой количество лимфогенных метастазов резко возрастает.
При подозрении на опухоль мочевого пузыря обследование больного следует начинать с ультразвукового исследования. При этом используют трансабдоминальное, трансректальное и внутрипузырное исследование. Оно всегда должно проводиться при заполненном мочевом пузыре. При этом можно определить и документировать объем мочевого пузыря, наличие и количество остаточной мочи после мочеиспускания, наличие опухолевых разрастаний в пузыре, их локализацию, размеры, количество, взаимоотношения с шейкой пузыря, реже - степень прорастания стенки, т.е. стадию заболевания.
Приходится констатировать, что независимо от используемого ультразвукового датчика, определить степень прорастания стенки мочевого пузыря опухолью удается далеко не всегда, однако наиболее информативным в отношении опухолевой инвазии является эндовезикальный датчик.
Для данного исследования нами используется интравезикальный зонд IR 16CK, который вводится в мочевой пузырь через резектоскоп 24Sh. Три выбираемых с помощью переключателя датчика с частотой 6 МГц позволяют осуществлять сканирование всего мочевого пузыря, обеспечивая углы облучения 90О, +45О, -45О. Эндовезикальное ультразвуковое исследование проведено 36 больным. Полученные результаты сравнивались с данными морфологического исследования после операции. При этом у 2 пациентов диагноз мышечной инвазии, определявшейся при ультразвуковом исследовании, не был подтвержден после оперативного вмешательства. У остальных пациентов данные ультразвукового и морфологического исследования совпали.
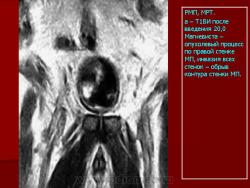
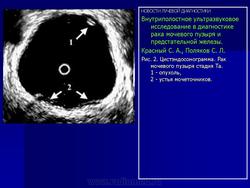
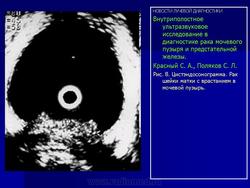
Эндовезикальное сканирование позволяет дифференцировать все слои мочевого пузыря (Рис. 1). Между мышечной стенкой и слизистой оболочкой визуализируется гипоэхогенная подслизистая соединительная ткань. При стадии рака мочевого пузыря Та (инвазия в пределах слизистой) создается впечатление, что опухоль отделена от мышечной стенки мочевого пузыря, то есть подслизистый слой остается неизмененным (Рис. 2), также хорошо визуализируются устья мочеточников. При распространении инвазии субэпителиальной соединительной ткани (стадия Т1) опухоль уже непосредственно прилежит к мышечному слою, но не инвазирует последний (Рис. 3).
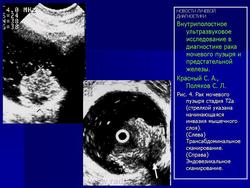
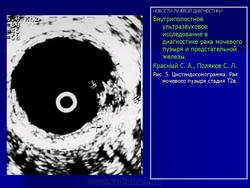
На Рис. 4 представлены эхограммы одного больного - трансабдоминальное и эндовезикальное исследование. Трансабдоминальное сканирование в данном случае не позволяет судить о глубине инвазии, а при эндовезикальном исследовании выявлена начинающаяся инвазия мышечного слоя, причем место инвазии визуализируется как гипоэхогенный участок на фоне гиперэхогенной мышечной ткани (стадия Т2а). Более четко визуализируется инвазия глубокого мышечного слоя (стадия Т2в) (Рис. 5).
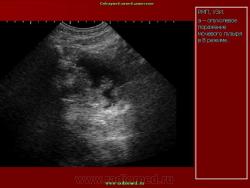
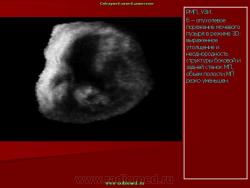
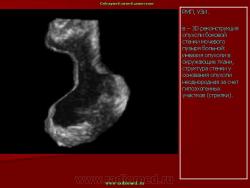
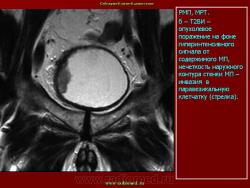
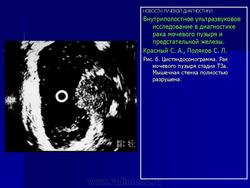
В случае прорастания опухолью всех слоев стенки мочевого пузыря при эндовезикальном сканировании четкая структура мышечной стенки отсутствует (Рис. 6), а опухолевая ткань распространяется на паравезикальную жировую клетчатку (стадия Т3).
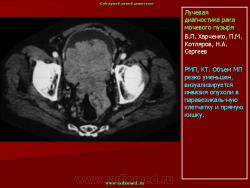
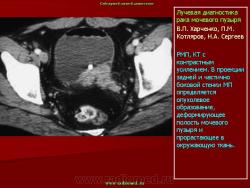
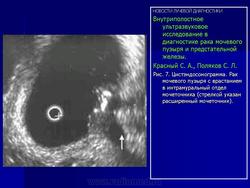
Эндовезикальное сканирование позволяет выявить распространение опухоли на интрамуральный отдел мочеточника (Рис.7) и предстательную железу (стадия Т4). Однако следует отметить, что при инвазии опухоли в предстательную железу более информативным является трансректальное сканирование. Что касается распространения опухоли на другие органы и ткани (брюшина, кости таза, тонкий кишечник и прямая кишка), то возможности эндовезикального исследования здесь ограничены. В подобных случаях значительную помощь в диагностике оказывает компьютерная томография. То же самое можно сказать и о диагностике метастатического поражения регионарных лимфатических узлов.
Большую помощь цистэндосонография может оказать в диагностике опухолей других локализаций, прорастающих стенку мочевого пузыря (Рис.8).
При выполнении трансабдоминальной ультрасонографии большие трудности возникают при выявлении опухолей, расположенных на передней стенке мочевого пузыря. Лишь в тех случаях, когда величина опухоли превышает 3 см, ее можно обнаружить при ультразвуковом наружном сканировании. Однако оценить степень местного распространения опухоли этой локализации с помощью трансабдоминальной ультрасонографии не представляется возможным. Большинство исследователей, изучавших информативность трансабдоминальной ультрасонографии в определении степени выраженности местного распространения злокачественного процесса у больных раком мочевого пузыря, отмечают существенные ограничения этого метода [4, 14, 19]. Показано, что трансабдоминальная ультрасо-нография является недостаточно информативным методом распознавания начальных стадий рака мочевого пузыря, особенно в тех случаях, когда опухоль локализуется на передней стенке органа [6, 17, 23, 25]. Это обусловлено препятствиями по ходу ультразвукового луча при выполнении трансабдоминальной ультрасонографии (большой массив тканей, лонное сочленение). Они затрудняют визуализацию всех отделов мочевого пузыря. В этих случаях применение эндовезикального ультразвукового сканирования оказывает существенную помощь в диагностике.
Кроме того, при внутриполостном ультразвуковом исследовании инкрустация поверхности опухоли солями не препятствует определению инвазии стенки мочевого пузыря. В то же время на трансабдоминальных томограммах у этого больного акустическая "тень" не позволяет судить о степени местного распространения рака.
Таким образом, с помощью цистоэндосонографии можно получить отчетливое изображение стенки пузыря в его различных отделах. Впервые о применении такой методики сообщил H.Holm в 1974 году [12]. В этой работе были представлены иллюстрации, подтверждающие идею о перспективности цистоэндосонографии для уточненной диагностики РМП. Дальнейший прогресс в области ультразвукового исследования мочевого пузыря связан с совершенствованием конструкции и уменьшением диаметра уретрального датчика. S. Nakamura и I. Niijima первыми применили датчик современной конструкции, работающий в режиме реального времени [17]. Ими было произведено сопоставление результатов цистоэндосо-нографического и морфологического исследований у 21 больного раком мочевого, пузыря. Степень местного распространения опухоли была правильно определена у 20 из них. Лишь в одном случае эндосонографическое заключение оказалось ошибочным, что было связано с обызвествлением опухоли. С. Pavone с соавторами также показали целесообразность применения цистоэндосонографии в определении ранних стадий инвазии РМП [18]. Т. Schuller с соавт. сообщили о 94-процентной диагностической точности трансуретральной сонографии у 28 пациентов [21]. Только в одном случае, когда у больного имел место РМП ТЗ (данные морфологического исследования), при ультразвуковом сканировании степень местного распространения была недооценена. В последние годы получены новые доказательства информативности этого метода в оценке местного распространения рака мочевого пузыря. В большинстве из этих публикаций сообщается, что с помощью трансуретральной ультрасонографии отчетливо визуализируются наружная граница опухоли, соотношение раковой ткани со стенкой мочевого пузыря (ее мышечным слоем) и соседними органами (в случае экстравезикального роста новообразования). В отличие от трансабдоминального и трансректального ультразвукового исследования с помощью цистоэндосонографии появилась возможность детального изучения опухолей небольшого размера [4, 6].
Для точной оценки начальных стадий инвазии опухоли в поверхностные отделы мышечной оболочки стенки пузыря более адекватным методом является цистоэндосонография. С помощью трансуретрального исследования можно отчетливо визуализировать мельчайшие изменения стенки мочевого пузыря, что позволяет определять местное распространение злокачественного процесса даже при очень небольших размерах опухоли. Однако этот метод не исключает риска повреждения слизистой оболочки уретры и требует применения общей анестезии. В связи с этим трансуретральное ультразвуковое сканирование не получило широкого применения, особенно в тех случаях, когда необходимо выполнять повторные исследования (например, при оценке эффективности лучевой и комбинированной терапии рака мочевого пузыря). Вместе с тем при решении вопроса о целесообразности выполнения трансуретральной резекции мочевого пузыря, а также для определения объема хирургического вмешательства цистоэндосонография является методом выбора.
В последние годы все большую актуальность в лечении больных раком предстательной железы занимает проблема раннего выявления этой патологии, поскольку результаты хирургического лечения этих пациентов можно считать удовлетворительными [24]. После радикальной простатэктомии десятилетняя выживаемость при I-II стадии рака простаты равна 75% [26]. В то же время, ранние стадии заболевания в нашей стране диагностируются крайне редко. Это связано с бессимптомным течением болезни на ранних стадиях и поздним обращением пациентов за медицинской помощью. В настоящее время определение уровня простат-специфического антигена (ПСА) у мужчин пожилого возраста позволило увеличить число случаев раннего выявления рака предстательной железы, что в свою очередь повлияло на внедрение радикальной простатэктомии в онкоурологических отделениях Республики Беларусь. И хотя ПСА в сочетании с пальцевым ректальным исследованием является наиболее значимым диагностическим приемом для диагностики РПЖ в I-II стадии заболевания, на сегодняшний момент трансректальное ультразвуковое исследование (ТРУЗИ) в сочетании с прицельной биопсией играют решающую роль для окончательного подтверждения диагноза и определения стадии заболевания на клиническом этапе диагностики [3, 8].
В современных трансректальных датчиках используются высокие частоты, что обеспечивает оптимальные параметры изображения, и позволяет детально визуализировать структуру простаты и окружающих ее органов и тканей. Трансректальный датчик компактен, имеет диаметр 15-20 мм, что делает исследование простым и необременительным для пациента. Наиболее удобными в работе являются многочастотные, многоплановые датчики, позволяющие изменять рабочую частоту и плоскость сканирования, что обеспечивает условия для осмотра всех отделов предстательной железы и окружающих органов и тканей [2].
Как известно, для получения качественного ультразвукового изображения необходим надежный акустический контакт рабочей поверхности датчика с исследуемой областью. С этой целью на датчик надевают специальный резиновый баллон, который плотно фиксируют резиновым кольцом. Через специальный штуцер в баллон вводится небольшое количество жидкости (воды) и удаляются пузырьки воздуха. Пациент располагается лежа на левом боку с согнутыми в коленях ногами или в гинекологическом кресле. Постепенно продвигая датчик, осматриваются предстательная железа, перипростатическая клетчатка, область семенных пузырьков, шейка и дно мочевого пузыря.
ТРУЗИ по сравнению с трансабдоминальным позволяет оценить состояние железы на качественно новом уровне. На поперечных и продольных ультразвуковых томограммах предстательной железы взрослого молодого человека можно выделить анатомические зоны, описанные McNeal [15] (Рис. 9).
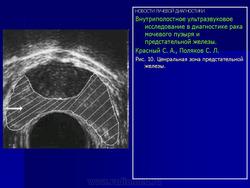
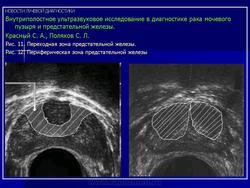
Нормальная периферическая зона (Рис. 10) предстательной железы относительно однородна и имеет мелкозернистую структуру, представленную отражениями средней интенсивности, за счет равномерного распределения железистых и стромальных элементов. Прилегающая центральная зона (Рис. 11) не всегда хорошо отличается от периферической и иногда они выглядят как одно целое. В связи с этим они могут не дифференцироваться на ультразвуковых томограммах. Переходная зона и периуретральные железы (Рис. 12) отличаются более низкой интенсивностью отражений, чем периферическая зона. Однако, при развитии доброкачественной гиперплазии эти зоны часто не различаются на ультразвуковых томограммах.
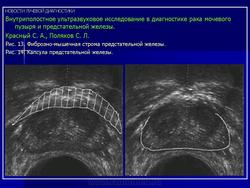
Фибромускулярная строма (Рис. 13) наиболее выражена на уровне семенного бугорка, меньшие ее части расположены на уровне основания и верхушки железы. Фибромускулярная строма состоит преимущественно из гладких мышц, которые хорошо проводят ультразвуковые волны. В связи с этим интенсивность отражений в передней части предстательной железы значительно ниже, чем в периферической зоне.
Предстательную железу окружают перипростатическая жировая клетчатка и фасция, интенсивно отражающие ультразвуковые волны. Эти ткани формируют гилерэхогенный "пограничный слой", описываемый многими исследователями как капсула железы (Рис. 14). Собственная капсула предстательной железы очень тонка и не всегда визуализируется на ультразвуковых томограммах. Используя высокочастотные датчики, в ряде случаев удается отдифференцировать собственную капсулу, которая определяется в виде тонкой, прерывистой, гипоэхогенной линии по поверхности железы. Семенные пузырьки визуализируются в виде симметричных гипоэхогенных тяжей, расположенных между простатой и мочевым пузырем.
Большинство злокачественных новообразований (70-80%) развиваются в периферической зоне предстательной железы и располагаются на глубине 3-4мм от поверхности органа [7, 16]. При локализации в области верхушки железы опухолевый процесс достаточно быстро распространяется на перипростатические ткани, так как в этой зоне капсула железы слабо выражена или вообще отсутствует. Из элементов центральной зоны развивается только 5% злокачественных опухолей предстательной железы. Большая часть опухолевых образований, обнаруживаемых в центральной зоне, являются следствием распространения опухолевого процесса из периферической или переходной зон. Переходная зона занимает всего 5% от объема железистой ткани органа, однако, в этой части железы развиваются от 10 до 20% злокачественных новообразований. Опухоли, исходящие из перходной зоны, наиболее сложны для ультразвуковой диагностики.
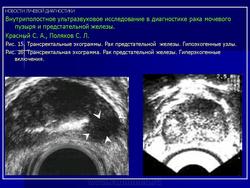
Рак предстательной железы также имеет характерные эхографические признаки. Опухолевым узлам чаще соответствуют участки пониженной эхогенности с неровным нечетким контуром (Рис. 15), причем центральная часть может иметь более интенсивный эхо-сигнал [13]. У 15-20% больных выявляются гиперэхогенные узлы (Рис. 16). Довольно часто опухолевый узел приобретает пестрый вид за счет образования гиалиновых телец, кальцинатов и участков распадающейся опухоли [11, 22].
В урологическом отделении НИИ онкологии и медицинской радиологии им. Н.Н. Александрова для выполнения ТРУЗИ используется бифокальный многоплановый ректальный датчик 1RW 177АК/В с ультразвуковой частотой 7,5 МГц (эхосканер Combison 320-5, Австрия), позволяющий осуществлять сканирование во фронтальной и в сагиттальной плоскостях. Во всех случаях подозрения на рак предстательной железы пациентам выполняется трансректальная биопсия подозрительного участка, так как порой бывает крайне сложно дифференцировать воспалительный и склеротический процесс от опухоли. В обязательном порядке перед ТРУЗИ у пациентов определяется уровень ПСА и выполняется пальцевое ректальное исследование. За 1999 и 2000 годы было выполнено 475 ТРУЗИ. Рак предстательной железы был обнаружен у 319 (67,2%) пациентов. Доброкачественная гиперплазия предстательной железы выявлена у 92 (19,4%) больных; хронический простатит, склероз простаты - у 43 (9,1%) больных. У 3 (0,6%) пациентов обнаружена забрюшинная опухоль, врастающая в предстательную железу и семенные пузырьки, у 18 (3,7%) мужчин патологии выявлено не было.
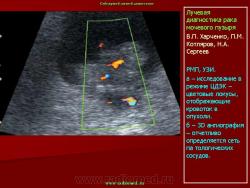
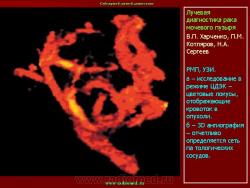
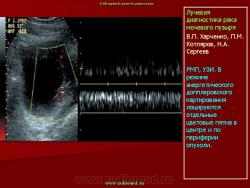
ТРУЗИ является важнейшим компонентом в алгоритме диагностики рака предстательной железы. ТРУЗИ позволяет не только визуализировать опухолевое образование, но и выявить признаки инвазии в капсулу, опухолевой инфильтрации семенных пузырьков, перипростатической клетчатки и мочевого пузыря [5, 20]. Все эти элементы диагностики крайне важны для определения степени местного распространения опухолевого процесса и стадирования заболевания. Выбор тактики лечения напрямую зависит от всех перечисленных выше критериев.
Таким образом, для оценки местного распространения опухолей мочевого пузыря, локализующихся в различных его отделах, целесообразно применять трансабдоминальную, эндовезикальную и трансректальную ультрасонографию как взаимодополняющие методы диагностики.
Трансректальное ультразвуковое исследование является информативным методом диагностики и стадирования рака предстательной железы. Выполнение ТРУЗИ может быть рекомендовано всем мужчинам при уровне ПСА выше 3,9 нг/мл, а также при наличии узловых и плотных образований обнаруженных при пальцевом ректальном обследовании. Сочетание всех выше названных компонентов с трансректальной биопсией может обеспечить наиболее раннее выявление пациентов с РПЖ.



Спасибо, за информацию! О существовании некоторых видах патологии я даже не знал ( грыжа мочевого пузыря и др.)
# 5 и 6 сообщения реклама. Надо убрать с сайта.
"Слушай всех, прислушивайся к немногим, решай сам".©