Уважаемые коллеги; давайте пообщаемся на тему ультразвуковой диагностики острого аппендицита. Используете ли вы УЗ-диагностику при подозрении на острый аппендицит в ваших клиниках и отделениях? Насколько хирурги работающие с вами "продвинуты" в этом вопросе? Какое ваше личное отношение к самому методу и насколько вы владеете им?
Исследование кишечника надо проводить линейными высокочастотными датчиками, минимум 5 мегагерц и выше. Необходимо запастись терпением и на забывать о значении адекватной компрессии. В ниже приведенных постах я публикую подборку из нескольких источников, которые есть в свободном доступе. С русским переводом первой книги я не полностью согласен, но книга относительно старая. Современные подход отражен в англоязычных источниках:
////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
Сонографические признаки патологии кишечника:
Тощая кишка шире, чем подвздошная, имеет более толстые стенки и больше круговых складок слизистой. В терминальном отделе подвздошной кишки складки слизистой становятся продольными. Это нормальные проявления, которые не должны ошибочно приниматься за патологию. Нерастянутые петли тонкого кишечника имеют вид «мишени» с гипоэхогенной мышечной стенкой в поперечном сечении. Мышечный слой подчеркнут эхогенным слоем, представляющим собой слизистую и подслизистую оболочки. Газ внутри просвета кишечника часто препятствует визуализации задней стенки кишки и глубжележащих структур.
1) Утолщение эхопрозрачного ободка (стенка кишечника). Точное измерение толщины стенки кишечника не дает достоверной диагностической информации из-за большой вариабельности толщины стенки при ее растяжении и перистальтике. Небольшое утолщение стенки кишки легко пропустить, а значительное утолщение обычно очевидно. Пищевод, желудок, кишечник 111
2) Асимметричное расположение эхогенных линий слизистой оболочки указывает на неравномерное утолщение стенки кишки. Асимметричное утолщение кишечной стенки — «атипичная мишень» — неспецифичное появление, но показательно при патологии
кишечника.
3) Слабое изменение конфигурации или слабая перистальтика при длительном наблюдении.
4) Неровный контур кишки.
Инфекционный энтерит: Mожет вызывать преходящие изменения тонкой кишки. Наиболее частая хроническая воспалительная болезнь тонкой кишки — болезнь Крона. В 80% случаев в патологический процесс вовлекается дистальный отдел подвздошной кишки. В 10% случаев болезнь ограничена толстой кишкой. В последние годы заболеваемость болезнью Крона повысилась. До 20% случаев диагно-
стируются в детстве. Ультрасонография может выявить изменения тонкой кишки типа очагового или диффузного утолщения стенки, тканевых образований, ригидности петель кишечника, абсцессов и т. д. При длительном течении фиброза стенки кишки становятся жесткими, толстыми, эхогенными, плохо визуализируются. Несмотря на то, что ультрасонография ненадежна в обнаружении кишечной патологии, обследование среднего и нижнего этажей брюшной полости может быть полезным у пациентов с клиническими признаками патологии тонкого кишечника.
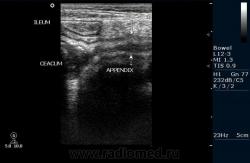
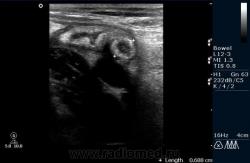
Аппендицит — второй по частоте воспалительный процесс в брюшной полости, гастроэнтерит стоит на первом месте. Аппендицит относительно редко встречается в грудном возрасте, чаще у детей и взрослых. Аппендицит возникает, когда препятствие в просвете аппендикса вызывает накопление секрета. Это растягивает стенку, вызывая ишемию. В присутствии бактериальной инфекции воспаленный аппендикс может перфорироваться уже через 6 ч после начала заболевания и риск перфорации с развитием перитонита увеличивается со временем. Если правая подвздошная ямка не закрыта газом кишки и пациент может вынести ультрасонографическое исследование, диагноз аппендицита можно подтвердить у тех пациентов, у которых симптомы недостаточно убедительно проявляются, чтобы гарантировать необходимость срочного хирургического вмешательства. С частотой 89% воспаление аппендикса может визуализироваться и его перфорация может быть предсказана в 80% случаев. Воспаление аппендикса выглядит как несдавливаемая трубчатая структура без перистальтики. В поперечном сечении он имеет типичный мишенеобразный вид кишки. Центральный расширенный просвет варьирует в пределах от 6 до 20 мм (в среднем
8 мм). Он окружен тонким эхогенным слоем, относящимся к слизистой оболочке и внешним гипоэхогенным слоем, представляющим отечную мышцу. Фекалии могут быть видны внутри просвета как эхогенные очаги с дистальной акустической тенью. Дополнительные признаки включают жидкость вокруг аппендикса, воспаленные ткани кишки и структуру абсцесса. В 30% в прилежащей брыжейке имеется лимфоаденопатия. В большинстве случаев аппендицит диагностируется клинически, но сонография имеет большое значение в оценке таких осложнений, как формирование абсцесса. Большинство аппендикулярных абсцессов возникает в тазу или правой подвздошной ямке, хотя гной может распространяться к поясничной мышце, подпеченочному или даже поддиафрагмальному пространству. Воспалительный процесс в брюшной полости может также вызывать тромбоз воротной вены и абсцесс печени, которые могут быть определены сонографически.
Аппендикулярный абсцесс
Аппендикулярные абсцессы часто развиваются в тех случаях, когда хирургическое вмешательство проведено в позднем периоде или произошел разрыв воспаленного аппендикса. Абсцессы обычно располагаются в тазу или правой подвздошной области и видны как анэхогенные образования неправильной формы. Маленькие абсцессы легко Пищевод, желудок, кишечник 115 спутать с петлями кишки и в сомнительных случаях исследование необходимо повторить, чтобы кишечные петли изменили свою конфигурацию. Большие абсцессы легко идентифицируются, располагаются вне просвета и могут содержать детрит.
Мукоцеле аппендикса
Прогрессивная кистозная дилатация аппендикса из-за закупорки просвета может происходить без бактериальной инфекции. В этом случае накопление слизи может вызывать появление кистозного образования в правой подвздошной области. В большинстве случаев это возникает из-за присутствия каловых масс или воспалительной стриктуры, но в 10% случаев- является вторичным проявлением злокачественной опухоли (чаще всего муцинозная цистаденокарцинома аппендикса). Разрыв мукоцеле может привести к псевдомиксоме брюшины. Стенографические проявления Кистозное образование, не связанное с паренхиматоз-
ными органами брюшной полости. Высокая эхогенность ткани из-за кальцификации. Гипертрофия слизистой, сгустки детрита и опухолевые узлы могут приводить к образованию узлов на внутренней стенке мукоцеле. Мукоцеле со множественными перегородками были описаны при компьютерном томографическом исследовании и, вероятно, будут видны при сонографии. Подвижные свисающие эхоструктуры могут наблюдаться из-за наличия детрита или белковых макроагрегатов. Мукоцеле может выглядеть гетерогенным без дистального усиления, особенно в том случае, если непосредственно сзади расположено крыло подвздошной кости.
Инвагинация
Инвагинация — образование грыжи сегмента кишки в смежный сегмент кишки способом, аналогичным укорачиванию телескопа. Большинство инвагинаций происходит у детей, причем в 95% случаев подвздошная кишка проходит в слепую и толстую кишку (илеоцекальная инвагинация). 75% случаев инвагинаций у детей происходит у мальчиков, самая высокая частота весной и осенью. Считается, что в возникновении инвагинации играет роль лимфоидное воспаление. Диагноз обычно устанавливается на основании клинических проявлений, когда у пациента развивается обструкция кишки с болями в животе и рвотой. У ребенка может быть стул типа «красносмородинового желе». У детей в 5% случаев имеется основная патология в верхушке инвагината типа полипа, дивертикула Меккеля, гамартомы, болезни Крона, пурпуры Шенлейн-Геноха или опухоли. У взрослых основная патология при инвагинации встречается значительно чаще. Сонографически инвагинация выглядит как тканевое образование кишки с множественными концентрическими эхогенными кольцами, которые образованы чередующимися слоями слизистой и мышечной оболочек. Такое проявление было описано как вид «пончика» на поперечном сечении и вид «псевдопочки» на продольном сечении. Внешняя граница обычно относительно эхопрозрачная из-за отека, Б то время как центральная часть образования может иметь один или больше слоев эхогенной складчатой слизистой оболочки. Похожий вид может быть при опухолях кишки, но они обычно дают другую клиническую картину. Описаны и другие проявления этой патологии, которые включают некротический энтероколит, заворот кишок и воспалительные заболевания кишечника. Было предпринято гидростатическое расправление инвагината под контролем ультразвукового исследования и оказалось, что чем больше эхогенность центрального кольца слизистой оболочки, тем с большей трудностью будет проходить лечение. Создается впечатление, что узкая центральная полоса слизистой оболочки отражает большое ее сжатие.
Differential Diagnosis in
Abdominal Ultrasound
R. A. L. Bisset
MBBS, FRCR, MHSM
Consultant Radiologist, North Manchester General
Hospital and Booth Hall Children's Hospital,
Manchester, UK.
A. N. Khan
MBBS, FRCP (Edin), MRCS, DMRD, FRCR, MHSM
Consultant Radiologist, North Manchester General
Hospital, Lecturer in Diagnostic Radiology, Faculty
of Medicine, University of Manchester, UK
1997
////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
Imaging Ultrasound in Acute appendicitis:
US should be the first preferred modality. The sensitivity and specifity for the diagnosis are both 85-95%.
A 5.0-7.5 MHz linear array transducer has to be used to examine the patient at the point of maximal tenderness
in the lower right abdomen. Gradually applied compression may displace other loops of the bowel. Longitudinal and transverse scans
are performed. If the appendix cannot be identified, a complete scan of the whole abdomen should be performed because of the variability of the appendiceal position and in order to exclude other reasons for the abdominal pain.
Possible Findings
? Transversal: target sign
? Diameter > 6 mm, not compressible
? Longitudinal: tubular structure, blind end
? Hyperperfusion
? Appendicoliths
? Periappendiceal / intraperitoneal fluid
? Abscess formation
Pitfalls
? Retrocecal appendix is difficult or even not visible
? After perforation the appendix is no longer distended
and is difficult to visualize; the patient feels sometimes
better after perforation
? Many other diseases may mimic appendicitis, such as
yersiniosis, Crohn’s disease, distal intestinal obstruction
in cystic fibrosis and even gastro-enteritis with
mesenteric adenitis
? Most serious differential diagnosis in female is the
torsion of the right ovary, so the ovaries have to be
visualized in the examination
? The first menstruation in young patients often causes
pain similar to an appendicitis
Primer of Diagnostic Imaging. Third edition. Mosby 2003
///////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
Целиакия:
Ultrasonography of infants with known celiac disease detects abdominal fluid and hyperperistalsis
in most. The US findings in adults include fluid-filled, dilated small bowel.
Disordered motility is common. Bowel wall thickening is mild; marked thickening suggests hypoproteinemia, and asymmetric thickening
raises suspicion for a neoplasm. Abdominal fluid is found in a minority. None of these findings are pathognomonic, but detection of
several findings should raise suspicion for this disease.
Болезнь Крона:
Abdominal US achieves sensitivities and specificities of 90% to 95% in detecting Crohn’s
disease location. With established disease, small bowel wall thickness is generally >5mm. Some authors consider an US bowel wall thickness >7mm to be “diagnostic” for inflammatory bowel diseases, a generous thickness indeed, which achieves high specificity, but, similar to CT, a thick bowel wall is not synonymous with Crohn’s disease. A stenosis, regardless of etiology, is usually associated with a thickened bowel wall. Effacement of the five bowel wall layers in a thickened bowel wall, as visualized by US, signifies more severe disease activity than if all five wall layers are identified. Little data exists on the accuracy of US in detecting mild small bowel abnormalities, such as the presence mostly of aphthae. Likewise, a correlation of bowel wall thickness with disease activity appears rather simplistic. Doppler US detects significantly greater superior mesenteric artery blood flow in patients with Crohn’s disease than in controls.Vessel density in affected bowel loops, measured by Doppler US, reflects disease activity. Superior mesenteric artery resistive indices (RI) also reflect disease activity.Whether such Doppler US blood flow measurements are of clinical relevance in detecting or following disease activity remains to be established. These findings of increased blood flow in diseased bowel should be balanced by laser Doppler flowmetry data from surgery revealing that blood flow in a bowel containing aphthae is slightly less than in normal tissue and with
inflammation progression bowel blood flowactually decreases. Ultrasonography probably detects most Crohn’s-associated abscesses, but the yield for stenoses and fistulas is inconstant and sufficiently low to limit the application of US to specific situations.
Ишемия:
Ultrasonography findings suggesting small bowel ischemia consist of thickened bowel wall and absent blood flow, identified by color Doppler US; bowel wall thickening with readily apparent color Doppler flow suggests inflammation.
Гематома тонкого кишечника:
Ultrasonography reveals a hematoma as focal bowel wall thickening, at times consisting of a thick, hyperechoic inner layer and a thin, hypoechoic outer layer; the bowel lumen tends to be narrowed, decreased peristalsis is evident, and often fluid is identified between involved bowel loops.
Обструкция тонкой кишки:
Ultrasonography studies of patients with acute abdominal pain have achieved sensitivities of 75% to 95% in detecting an obstruction, yet
closer perusal makes it difficult to place these studies in a proper perspective. Ultrasonography is more often employed to study the bowel in Europe rather than the United States or Canada, where it has been supplanted by CT and, to a lesser extent, by MRI. Conventional US readily identifies extraluminal fluid; such fluid is present in about two thirds of patients with small bowel obstruction.
Duplex Doppler US has been used to differentiate between obstruction and paralytic ileus, with results similar to those obtained during a
physical examination,namely, in the early stages of mechanical obstruction. Doppler US reveals hyperperistalsis proximal to the obstruction; in long-standing obstructions, as expected, a decrease in intensity and duration of peristalsis predominates. Dilated and atonic segments are identified in adynamic ileus, although some bowel motility usually is still present. Fluoroscopic observation of contrast-filled loops of bowel identifies similar peristaltic activity, although most fluoroscopists tend to rely little on these observations.
УЗИ в диагностике заболеваний толстой кишки:
Compared to other intraabdominal sites, colon US is rather limited. In some centers it has found a niche in following patients with colonic
Crohn’s disease but appears less useful with ulcerative colitis and diverticulitis. Its role in pediatric intussusception reduction is well established, less so in adult tumor detection and staging. Ultrasonography findings are not disease-specific. Also, in general, a negative US examination does not exclude disease. Colon US performed after a water enema is called hydrocolonic sonography (occasionally a
methylcellulose-water mixture is used). Hydrocolonic US does detect larger polyps but it is very operator dependent and has been overshadowed by CT colonography. Doppler US evaluates colonic blood flow. Thus viability of an obstructed bowel segment is suspected if Doppler US detects no blood flow. Similarly, in inflammatory bowel disease and in acute appendicitis Doppler flow through a thickened bowel segment can suggest an acute or ongoing inflammation. The published terminology is somewhat inconsistent for US performed with rectal probes: Endoscopic and endoluminal US include either a rectal or vaginal probe, whereas the terms transrectal and endorectal US are used interchangeably. Anorectal echo-endoscopy and similar terms are also in use. Endovaginal US evaluates the rectum and adjacent structures, including puborectalis muscle thickness, sphincter thickness, and sphincter defects. Distending the rectum with a water enema better delineates perirectal tissue planes. Endorectal US defines surrounding structures. Urogenital structures and perirectal spaces are readily imaged. Both proctography and endorectal US evaluate internal and external rectal sphincters. Three-dimensional endorectal US appears to provide more accurate control of a biopsy needle toward a perirectal lesion than is available with other modalities, although the data for this are sparse. The current primary use of endorectal US is in a setting of rectal cancer and in the workup of evacuation disorders. Available US miniprobes fit through the working channel of an endoscope. Similar to upper gastrointestinal endoscopic US, the role of flexible colonoscopic US in detecting and staging neoplasms is not yet clear.
Jovitas Skucas
Advanced Imaging of the Abdomen
© Springer-Verlag London Limited 2006
Mario Taha MD




Не владею, к сожалению. В идеале УЗИ поставить в приемном отделении и обучить хотя бы по минимуму врачей-дежурантов... наверное, не в этой жизни)
"Предоставляя весь смысл и совершенство в распоряжение одного только Бога, вы избавляете себя от бездны хлопот." Джон Уитборн.