Б.А.Черняк, И.Н.Трофименко
Одной из актуальных проблем современной медицины являются побочные эффекты лекарственных средств (ЛС), частота которых по мере расширения спектра медикаментозных препаратов в последние десятилетия существенно возрастает. Следует подчеркнуть, что представление о лекарственно-индуцированных поражениях (ЛИП) разных органов и систем, как правило, не включает патологические процессы, связанные с передозировкой ЛС или их ошибочным применением. При этом легкие являются одной из наиболее частых мишеней лекарственных поражений, уступая по частоте лишь коже и пищеварительной системе. По данным ряда исследований, частота ЛИП легких (ЛИПЛ) составляет в структуре заболеваемости около 5%, достигая среди госпитализированных больных 15-25%. Однако точно оценить распространенность ЛИПЛ весьма затруднительно, более того, имеются все основания говорить о гиподиагностике лекарственных поражений легких. Это связано с несколькими обстоятельствами: пневмотоксичные ЛС назначаются врачами разных специальностей, часто недооценивающими сопутствующие или вновь появившиеся респираторные симптомы, недостаточной чувствительностью рентгенографии легких по сравнению с компьютерной томографией высокого разрешения, невозможностью выполнить инвазивные диагностические процедуры в связи с тяжелым состоянием онкологических больных, когда ЛИПЛ встречаются часто, и, наконец, с недостаточным уровнем регистрации осложнений фармакотерапии.
Факторы риска и механизмы развития ЛИПЛ
К настоящему времени перечень ЛС, способных вызвать ЛИПЛ, чрезвычайно широк и включает более 350 препаратов. Наиболее часто среди них регистрируются амиодарон, нитрофураны, антибактериальные средства, цитостатики, нестероидные противовоспалительные препараты (НПВП), b-блокаторы, ингибиторы ангиотензинпревращающего фермента (ИАПФ) и др.
Важным и пока далеким от разрешения остается вопрос, почему не у всех пациентов, принимающих препараты с известной легочной токсичностью, развивается ЛИПЛ. Для большинства ЛС, обусловливающих легочные поражения, не имеет значение доза и продолжительность их применения. Лишь для некоторых препаратов (амиодарон, блеомицин) отмечен дозозависимый эффект, когда низкие дозы рассматриваются как безопасные. Среди других факторов риска ЛИПЛ обсуждаются предшествующие реакции дыхательной системы на прием ЛС и некоторые заболевания, по поводу которых назначается препарат. Например, ревматоидный артрит или неспецифический язвенный колит увеличивают риск ЛИПЛ. В частности, у больных с ревматоидным артритом возрастает число случаев «метотрексатового» легкого и туберкулеза легких вследствие использования анти-TNF-препаратов. Рассматриваются в качестве факторов риска и некоторые профессиональные воздействия. Так, например, контакт с асбестом увеличивает частоту ЛИПЛ. Вместе с тем, несмотря на некоторые перечисленные и ряд других факторов риска, касающихся особенностей активации, метаболизма и фармакокинетики ЛС, индивидуальный прогноз ЛИПЛ в большинстве случаев остается непредсказуемым, что затрудняет профилактику и раннюю диагностику ЛИПЛ.
Высокая восприимчивость легких к лекарственному воздействию определяется их морфофизиологическими особенностями и высоким уровнем метаболизма, в процессе которого происходит активное образование и высвобождение свободных радикалов. Среди механизмов лекарственного повреждения легких важное значение придается оксидативному стрессу, непосредственному токсическому действию ЛС на альвеолокапиллярный барьер, отложению липидных соединений в клетках - фосфолипидозу, образованию легочных антител и иммунных комплексов.
ЛИПЛ чаще протекают изолированно, однако лекарственные пневмопатии могут быть и частью системных патологических процессов, индуцированных ЛС. Среди последних в литературе выделяется несколько вариантов: 1) волчаночный синдром, встречающийся, например, при приеме гидралазина, b-блокаторов, НПВП; 2) синдром гиперчувствительности с вовлечением сердечно-сосудистой и пищеварительной систем, головного мозга, лимфатических узлов, костного мозга, встречающийся при использовании противосудорожных препаратов; 3) альвеолярно-геморрагический синдром с почечной недостаточностью, развивающийся у пациентов, принимающих пеницилламин; 4) полиангиит с вовлечением легочных капилляров и образованием нейтрофильных цитоплазматических антител (ANCA) при применении антитиреодных ЛС; 5) синдром Churg-Strauss при использовании аспирина, макролидов.
Диагностика ЛИПЛ
Своевременная диагностика ЛИПЛ представляется чрезвычайно важной, поскольку во многих случаях отмена препарата способствует купированию и разрешению патологического процесса. Основным диагностическим критерием ЛИПЛ является временная зависимость между приемом ЛС и возникновением клинических проявлений. Хронологическая связь может быть установлена также на основании анализа рентгенографии легких до начала приема препарата или улучшения клинико-рентгенологических симптомов после его отмены. Диагностические трудности нередко обусловлены, с одной стороны, поздней клинико-рентгенологической манифестацией (длительный период времени от начала приема ЛС или после его отмены), с другой - отсутствием улучшения состояния после прекращения приема ЛС. Другой диагностической трудностью является отсутствие достаточно специфичных признаков ЛИПЛ для большинства ЛС. Клинические признаки лекарственных пневмопатий представлены широким спектром: от малосимптомных «летучих» инфильтратов до жизнеугрожающих состояний - тяжелого респираторного дистресс-синдрома (РДС).
ЛИПЛ может протекать по типу острых, подострых или хронических патологических процессов. Клиническая картина острого ЛИПЛ характеризуется лихорадкой, кашлем, одышкой, возможно развитие гипоксемической острой дыхательной недостаточности (ОДН). На компьютерной томограмме легких при ранних стадиях заболевания выявляются линейные тени, утолщение междолькового и внутридолькового интерстиция, симптом «матового стекла» или милиарный паттерн теней. Острые формы ЛИПЛ необходимо дифференцировать от инфекционных поражений легких, имеющих близкую имидж-картину. В диагностике гиперчувствительного пневмонита и эозинофильной пневмонии помогает анализ жидкости бронхоальвеолярного лаважа (БАЛ), в которой отмечается увеличение уровня лимфоцитов, эозинофилов и альвеолоцитов 2-го типа. Кроме того, БАЛ позволяет исключить инфекционный процесс в легких у пациентов, принимающих иммуносупрессивную терапию.
Для большинства случаев ЛИПЛ характерно подострое или хроническое течение, сопровождающееся субфебрилитетом, непродуктивным кашлем, умеренной одышкой, нерезко выраженной гипоксемией, неоднородной легочной инфильтрацией. Среди ЛС, вызывающих медленно прогрессирующие варианты пневмопатий, наиболее часто отмечаются ИАПФ, b-блокаторы, прокаинамид, симвастатин, сульфасалазин, метотрексат и др. Инфильтраты имеют диффузный или локализованный характер с преимущественным вовлечением средненижних отделов и крайне редко - апикальных зон легких. Компьютерные томограммы, как правило, характеризуются синдромом «матового стекла» или неоднородными участками плотной альвеолярной консолидации, утолщением внутридолькового интерстиция. Плевральный выпот, медиастинальная лимфаденопатия нехарактерны и встречаются очень редко. Рестриктивные нарушения дыхания и выраженность гипоксемии коррелируют с обширностью вовлечения легочной паренхимы. БАЛ позволяет исключить инфекционный процесс и характеризуется преобладанием лимфоцитов (CD4+ или CD8+), тогда как преобладание нейтрофилов и/или эозинофилов встречается значительно реже.
Обычно отмена «виновного» препарата и назначение системных кортикостероидов (СКС) сопровождаются обратным развитием патологического процесса, в связи с чем необходимость легочной биопсии для верификации ЛИПЛ возникает редко.
Клинические варианты ЛИПЛ
Общепринятой классификации ЛИПЛ не существует. В зависимости от уровня поражения респираторной системы выделяют разные варианты лекарственных пневмопатий. ЛИПЛ могут протекать с вовлечением в патологический процесс бронхов (астмоподобный синдром и кашель), мелких дыхательных путей (бронхиолит), интерстиция (интерстициальные пневмонии), плевры (плеврит, пневмоторакс), сосудов (васкулит).
Поражение воздухоносных путей
Лекарственные кашель и бронхоспазм могут возникать на фоне приема b-блокаторов, что наиболее часто наблюдается у пациентов с бронхообструктивными заболеваниями. Развитие бронхиальной обструкции, в том числе и очень тяжелой, возможно при приеме аспирина или НПВП у лиц с непереносимостью ацетилсалициловой кислоты. В структуре ятрогенного кашля на долю ингаляционных препаратов, ИАПФ и b-блокаторов приходится 75%.
Среди больных, принимающих ИАПФ, непродуктивный кашель развивается в 5-20% случаев. Предполагается, что в патогенезе кашлевого синдрома на фоне приема ИАПФ ведущую роль играют накапливающиеся в легочной ткани такие провоспалительные медиаторы, как брадикинин, субстанция Р, простагландины, резко повышающие кашлевой рефлекс. У больных астмой брадикинин может вызывать не только кашель, но и эпизоды бронхиальной обструкции, чем объясняется возможное снижение контроля над течением заболевания. Кроме того, ИАПФ способны увеличивать продукцию NO в дыхательных путях, что также может стимулировать кашлевой рефлекс и бронхоспазм. У части пациентов кашель возникает уже через несколько часов после приема первой дозы ИАПФ, у других - через недели и месяцы. Поскольку не существует клинических или лабораторных предикторов кашля в связи с приемом данных ЛС, диагноз лекарственного кашля должен рассматриваться в качестве вероятного у каждого пациента, предъявляющего жалобы на кашель в период приема ИАПФ.
Тяжелым вариантом лекарственного поражения малых дыхательных путей является развитие облитерирующего бронхиолита (ОБ). Лекарственно-индуцированный ОБ описан в связи с приемом нитрофуранов, сульфаниламидов, пенициллинов, наркотических препаратов, цитостатиков, солей золота, аспирации минеральных масел. Около 25% всех случаев лекарственного ОБ приходится на амиодарон. Для ОБ свойственна необратимая перестройка дыхательных путей с формированием тяжелой бронхиальной обструкции, эмфиземы и пневмосклероза. Необходимо отметить, что даже своевременная отмена причинно значимых ЛС при облитерирующем бронхиолите, как правило, не сопровождается восстановлением морфофункциональных нарушений органов дыхания. В большинстве случаев при лекарственном ОБ имеет место плохой ответ на терапию СКС, цитостатиками и, соответственно, неблагоприятный прогноз.
Интерстициальные заболевания легких
Интерстициальный легочный процесс является наиболее частым проявлением ЛИПЛ и требует такого же диагностического подхода, как и при интерстициальных легочных заболеваниях другого генеза. Лекарственно-индуцированные интерстициальные поражения легких встречаются приблизительно в 3% случаев от всей интерстициальной легочной патологии. Под влиянием ЛС формируются разные варианты поражения легочного интерстиция: обычная интерстициальная пневмония, неспецифическая интерстициальная пневмония, десквамативная интерстициальная пневмония, лимфоцитарная интерстициальная пневмония, организующаяся пневмония, эозинофильная пневмония. Как правило, интерстициальный процесс при ЛИПЛ соответствует нескольким патогистологическим паттернам, включая интерстициальные пневмонии, поражения альвеол и легочный васкулит, сопровождающиеся легочными инфильтратами, которые сложно дифференцировать методами имидж-диагностики. БАЛ также не всегда позволяет отличить ЛИПЛ от других интерстициальных пневмоний нелекарственного генеза.
Некоторые ЛС (нитрофураны, НПВП) вызывают, как правило, весьма стереотипные легочные реакции в виде неспецифической интерстициальной или эозинофильной пневмонии. Кроме уже отмеченных ЛС, эозинофильная пневмония может развиваться на фоне многих других медикаментозных препаратов: антибиотиков, сульфаниламидов, туберкулостатиков, ИАПФ, амитриптилина, интерлейкина-2, триптофана. В этих случаях при компьютерной томографии легких обнаруживаются плотные двусторонние линейные или альвеолярные затемнения, которые могут сочетаться с двусторонним плевральным выпотом, может иметь место лимфаденопатия. Диагноз «эозинофильная пневмония» подтверждается эозинофилией крови, жидкости БАЛ и легочной ткани. Легочная биопсия при эозинофильной пневмонии выполняется редко, поскольку анализ жидкости БАЛ является при этой форме ЛИПЛ основным методом диагностики. Эозинофильная пневмония, как правило, быстро разрешается на фоне отмены «виновного» препарата и назначения СКС, но при повторном назначении препарата, обусловившего ее, возможен рецидив.
Большинство же медикаментозных препаратов вызывает развитие разных патогистологических паттернов. Так, например, описание гистологических препаратов «амиодаронового» легкого может включать скопление пенистых макрофагов в альвеолах, признаки организующей и неспецифической интерстициальной пневмонии, интерстициальный легочный фиброз, диффузное альвеолярное повреждение как изолированные патоморфологические варианты или их сочетание. Другими примерами разных сочетаний морфологических признаков ЛИПЛ могут быть организующаяся и эозинофильная пневмония, диффузное альвеолярное повреждение, отек легких и/или альвеолярные геморрагии. Отмеченные особенности ЛИПЛ в значительной степени затрудняют определение доминирующего типа поражения, когда доступен лишь маленький образец легочной паренхимы, получаемый при трансбронхиальной биопсии. В связи с этим при необходимости предпочтение отдается видеоторакоскопической биопсии.
Характеризуя интерстициальные формы ЛИПЛ, необходимо отметить и группу лекарственных пневмопатий, обусловленных химиотерапевтическими препаратами (блеомицин, циклофосфамид, метотрексат, 6-меркаптопурин, азатиоприн и др.). Эти ЛС способны вызывать тяжелые поражения легких, развивающиеся во время их применения или вскоре после прекращения химиотерапии. Следует отметить, что риск ЛИПЛ возрастает на фоне высоких доз цитостатических препаратов и полихимиотерапии. Дополнительными факторами риска ЛИПЛ у данной категории больных являются сопутствующая лучевая и оксигенотерапия, а также повторные курсы химиотерапии.
Для поражений легких, вызванных химиотерапевтическими ЛС, характерны такие патогистологические паттерны, как диффузное альвеолярное повреждение, отек легких, ранний фиброз, облитерирующий бронхиолит. Основным клиническим признаком является одышка, быстро достигающая степени тяжелой дыхательной недостаточности. При рентгенологическом исследовании и компьютерной томографии определяются диффузные легочные инфильтраты, отмечается синдром «матового стекла». В целом поражения легких при химиотерапии имеют плохой ответ на терапию СКС и неблагоприятный прогноз.
Отек легких
Лекарственно-индуцированный (некардиогенный) отек легких развивается при применении таких препаратов, как наркотические анальгетики, аспирин и другие НПВП, высокие дозы b2-агонистов при внутривенном введении, гидрохлоротиазид, колхицин, циклофосфамид, метотрексат, нитрофураны, трициклические антидепрессанты, героин («героиновое» легкое), нифедипин, простациклин, рентгеноконтрастные средства, гемотрансфузии. В отличие от других ЛИПЛ отек легких развивается очень быстро (в течение минут) после применения большинства из перечисленных препаратов и несколько медленнее при использовании гидрохлоротиазида и аспирина. При этом клинические проявления сходны с другими формами острых лекарственных поражений легких: возникает одышка, быстро перерастающая в ОДН, развивается картина РДС. При рентгенологическом исследовании регистрируются диффузные легочные инфильтраты. Ведение таких пациентов требует, безусловно, прекращения приема препарата, вызвавшего отек легких, при формировании ОДН необходима респираторная поддержка. Диуретики при лекарственно-индуцированном отеке легких могут усугубить состояние больного, роль СКС при лечении таких пациентов до настоящего времени не ясна.
Легочные (альвеолярные) геморрагии
Лекарственно-индуцированные альвеолярные геморрагии (ЛИАГ) описаны при применении таких препаратов, как антикоагулянты, фибринолитики, аспирин, аллопуринол, азотиоприн, клопидогрель, нитрофураны, ретиноевая кислота и др. ЛИАГ проявляются изолированно или с поражением других органов, чаще почек, с признаками микрополиангиита. Лечение гидралазином, пеницилламином, тиоурацилом может сопровождаться развитием легочно-ренального синдрома, напоминающего синдром Гудпасчера или гранулематоз Вегенера. Диагноз подтверждается с помощью анализа жидкости БАЛ, в которой обнаруживается большое количество эритроцитов. При подостром течении заболевания присутствуют макрофаги с гемосидерином. Исследование антинейтрофильных и антицитоплазматических антител позволяет дифференцировать ЛИАГ от диффузных альвеолярных геморрагий, ассоциированных с системными заболеваниями. При развитии ЛИАГ необходима отмена препарата. В случаях тяжелых геморрагических проявлений или мультиорганной недостаточности назначаются СКС или иммуносупрессивные препараты.
«Амиодароновое» легкое
Амиодарон - антиаритмический препарат с доказанной легочной токсичностью. Последняя обусловлена нарушением нормального метаболизма эндогенных фосфолипидов, которые на фоне длительного приема амиодарона накапливаются в легочной ткани. Особенности фармакокинетики амиодарона обусловливают характерный для него профиль легочной токсичности, что во многом связано с очень длительным периодом полувыведения - в течение 6-12 мес. Поэтому для «амиодаронового» легкого в подавляющем большинстве случаев типично медленное начало, вялотекущее улучшение после отмены препарата, возможное развитие или рецидив симптомов после прекращения приема.
Хотя острое повреждение легких при приеме амиодарона в целом не характерно, тем не менее оно может развиться через несколько дней после внутривенного введения высоких доз препарата. Случаи острого «амиодаронового» легкого описаны после оперативных вмешательств на сердце или легких. Наркоз, оксигенотерапия и механическая вентиляция являются дополнительными факторами риска острого «амиодаронового» легкого. Оно манифестирует одышкой, тяжелой гипоксемией, картиной острого РДС, диффузными альвеолярными и интерстициальными затемнениями. Смертность при остром «амиодароновом» легком достигает 40-50%, несмотря на отмену препарата и кортикостероидную терапию.
Хроническая форма «амиодаронового» легкого развивается примерно у 0,1% пациентов, получающих низкие дозы, и около 50% больных, использующих высокие дозы препарата. Поражение легких, вызванное амиодароном, развивается во временном интервале от несколько недель до нескольких лет терапии данным ЛС (в среднем через 18-24 мес).
Обычно «амиодароновое» легкое манифестирует одышкой, сухим кашлем, потерей массы тела, недомоганием, умеренной лихорадкой и иногда плевральным болевым синдромом. При аускультации часто обнаруживаются крепитация и влажные хрипы в легких. Среди лабораторных показателей могут иметь место лейкоцитоз и увеличение уровня лактатдегидрогеназы, что может даже предшествовать клиническим симптомам. В качестве дифференциально-диагностического критерия «амиодаронового» легкого и кардиогенного отека легких, часто встречающегося у данной категории больных, может использоваться уровень мозгового натрийуретического пептида.
Имидж-диагностика характеризуется билатеральными, часто асимметричными интерстициальными или альвеолярными инфильтратами, которые могут вовлекать все легочные поля, включая апикальные зоны. Компьютерная томография позволяет визуализировать выраженную плотность и уменьшение объема чаще верхней доли правого легкого, а также контралатеральное снижение прозрачности. Иногда могут встречаться одиночные или множественные субплевральные участки поражения легочной ткани и соответствующее им утолщение плевры. Реже встречаются двусторонние апикальные образования по типу формирования неоднородных узлов. Вероятность диагноза значительно возрастает при наличии документированной нормальной рентгенографии легких до назначения препарата и развитии легочного фиброза на фоне терапии амиодароном или после ее прекращения. Безусловно, что при этом должны исключаться и другие потенциальные причины легочных изменений.
Цитологический состав жидкости БАЛ при «амиодароновом» легком широко варьирует от нормальных показателей до высокого содержания нейтрофилов и/или лимфоцитов. Однако обнаружение в цитограмме БАЛ пенистых макрофагов с высокой степенью вероятности указывает на диагноз «амиодаронового» легкого.
Большинство авторов считают необходимым назначение СКС, которые позитивно влияют на разрешение «амиодаронового» легкого, поскольку только отмена препарата в большинстве случаев не сопровождается положительной динамикой легочных изменений. Длительно же сохраняющиеся легочные нарушения, обусловленные амиодароном, как правило, трансформируются в необратимый пневмофиброз. С учетом фармакокинетических особенностей амиодарона продолжительность терапии СКС должна составлять несколько месяцев с последующим постепенным снижением их дозы. Рецидив «амиодаронового» легкого при быстрой отмене СКС может иметь более тяжелое течение и плохой ответ на повторную терапию СКС. В целом летальность при «амиодароновом» легком составляет менее 10% у амбулаторных пациентов и бывает значительно выше (20-23%) у госпитализированных больных с поздним диагнозом.
С целью профилактики и ранней диагностики ЛИПЛ у больных, получающих амиодарон, рентгенография органов грудной клетки должна быть выполнена до назначения препарата и регулярно проводиться каждые 4-12 мес в зависимости от дозы препарата. Кроме того, необходимо проводить мониторинг функции внешнего дыхания, включая оценку диффузионной способности легких, особенно в первые месяцы приема препарата. Снижение диффузионной способности легких с нарастающей выраженностью за короткий период является самым ранним функциональным признаком «амиодаронового» легкого.
«Метотрексатовое» легкое
Частота пневмопатий на фоне приема метотрексата составляет, по данным разных авторов, от 0,3 до 11,6%. «Метотрексатовое» легкое может развиться при любой продолжительности приема препарата, но риск возникновения ЛИПЛ выше в течение 1-го года терапии. Вместе с тем имеются данные о формировании «метотрексатового» легкого только через 5 лет от начала терапии. При этом тяжесть течения заболевания не зависит от длительности приема и дозы метотрексата. Чаще всего пневмопатия, обусловленная метотрексатом, характеризуется подострым течением (недели от начала приема), реже - острым (дни) и хроническим (месяцы). К факторам риска «метотрексатового» легкого относят диабет, гипоальбуминемию, поражения легких при ревматоидном артрите, пожилой возраст.
Легочные изменения при метотрексатовой пневмопатии носят диффузный характер либо преобладают в нижних отделах. Возможны разные патогистологические варианты «метотрексатового» легкого: гиперчувствительный пневмонит, острая интерстициальная пневмония, организующаяся, эозинофильная пневмония и др. Кроме того, у 20% больных регистрируются эозинофильный васкулит и поражения легких гранулематозного характера.
Клинические признаки «метотрексатового» легкого малоспецифичны и проявляются у большинства пациентов сухим кашлем, одышкой, лихорадкой. Симптоматика на начальном этапе заболевания может опережать его рентгенологические проявления, которые в течение первых недель могут отсутствовать. Затем поражение легких быстро прогрессирует с возникновением плотных диффузных альвеолярных затемнений и снижением легочного объема. Диагностические признаки «метотрексатового» легкого включают следующие критерии: прогрессирующую одышку, лихорадку свыше 38°С, тахипноэ более 28 в минуту, наличие признаков интерстициальных изменений при лучевой диагностике, лейкоцитоз свыше 15 тыс.і109, отрицательные результаты бактериологических исследований крови, мокроты и жидкости БАЛ на микрофлору, рестриктивные нарушения функции внешнего дыхания со снижением диффузионной способности легких, PaO2<50 мм рт. ст., верификацию интерстициального легочного процесса с помощью биопсии. Диагноз «метотрексатового» легкого считается определенным при наличии не менее 6 из перечисленных выше критериев, вероятным и возможным - при наличии 5 или 4 критериев соответственно.
При подозрении на «метотрексатовое» легкое важное значение для дифференциального диагноза с оппортунистическими инфекциями приобретает БАЛ, поскольку пневмонии, вызываемые Pneumocystis jiroveci, cytomegalovirus, Cryptococcus, herpes zoster, Nocardia, имеют аналогичную клиническую и рентгенологическую картину и, кроме того, эти возбудители ассоциируются с приемом метотрексата, особенно при кумулятивной дозе более 700 мг.
Лечение «метотрексатового» легкого предполагает отмену метотрексата и назначение СКС, показаниями для которых являются снижение диффузионной способности легких на 20% от исходного уровня, десатурация при физической нагрузке, наличие симптома «матового стекла», по данным компьютерной томографии или выраженных инфильтративных изменений, выявляемых рентгенологически. Длительность кортикостероидной терапии при этом варианте ЛИПЛ составляет 1-3 мес. Отмена метотрексата и высокие дозы кортикостероидов способствуют, как правило, благоприятному исходу «метотрексатового» легкого. Картина легких при рентгенологическом исследовании и компьютерной томографии, а также параметры легочной функции улучшаются через несколько недель и восстанавливаются при отсутствии рецидива через несколько месяцев. Вместе с тем летальность при остром «метотрексатовом» легком достигает 15%. Повторное назначение мето-
трексата противопоказано, поскольку ассоциировано с более тяжелым поражением легких и летальным исходом.
Заключение
Таким образом, диагноз ЛИПЛ должен основываться на тщательном исключении других возможных причин патологических изменений со стороны респираторной системы. Основным диагностическим критерием лекарственной пневмопатии является связь возникновения клинико-функциональных и рентгенологических проявлений заболевания с приемом тех или иных ЛС. Информированность врачей о побочных действиях ЛС и мониторинг пациентов, получающих фармакотерапию ЛС, с потенциальной легочной токсичностью должны рассматриваться как основные мероприятия по предупреждению возникновения и прогрессирования ЛИПЛ. У большинства пациентов с лекарственными поражениями легких своевременная диагностика и отмена «виновного» препарата, а также терапия СКС сопровождаются значительным улучшением клинической и рентгенологической симптоматики заболевания.
Марченков Я.В.
Лекарственно-индуцированные поражения легких.
Общая информация.
Анатомия лекарственно-индуцированных поражений легких
Сроки возникновения лекарственно-индуцированных реакций
Иногда лекарственно-индуцированные интерстициальные поражения легких развиваются после прекращения воздействия препарата:
- реакция на амиодарон развивается через несколько недель после прекращения его приема;
- реакция на противоопухолевые химиотерапевтические препараты может развиваться через месяцы и годы после прекращения их приема у пациентов, получающих лучевую терапию («recall pneumonitis»).
Диагностика лекарственно-индуцированного поражения легких
Статины и Ингибиторы АПФ




У Марченкова Ярослава Владимировича, ФГУ НИИ пульмонологии ФМБА, есть великолепная лекция на эту тему, "Лекарственно-индуцированные поражения легких".
"Первые сообщения в 1980 году; наиболее частая и тяжелая формалекарственно-индуцированного интерстициального процесса в легких.
«Амиодароновое легкое» развивается у 0,1 - 0,5% пациентов принимающих 200 мг/день и у 15% принимающих ≥500 мг/день.
Вероятность развития лекарственно-индуцированной реакции возрастает не только с увеличением дозы, но и с увеличением продолжительностилечения. Наиболее часто лекарственно-индуцированная реакция развивается через 18 мес. терапии.
Необходимость ГКС терапии при значительных функциональных нарушениях и/или отсутствии улучшений через 1 мес. после отмены амиодарона. Продолжительность терапии : 6-12 мес.
Радиологическая картина
* Симптом «матовое стекло»;
* Участки локального альвеолярного уплотнения легочной ткани, могут иметь мигрирующий характер;
Аналогичная рентгеносимиотика может наблюдаться и при других лекарственно-индуцированных процессах в легких, что является проявлением вариабельности клинико-рентгенологического паттерна."
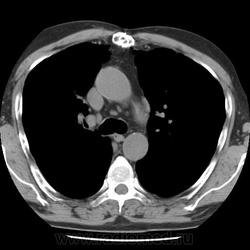
Амиодарон - индуцированные изменения в ОГК.
Экзогенный аллергический альвеолит
Экзогенный аллергический альвеолит (ЭАА) - общее название группы аллергических пневмопатий, которые возникают вследствие аллергической реакции легочной ткани на интенсивные и длительные ингаляции определенного рода антигенов. Заболевание представляет собой диффузный гранулематозный воспалительный процесс альвеол и интерстициальной ткани легких, развивающийся под влиянием интенсивной и продолжительной ингаляции преимущественно органических водонерастворимых антигенов. Впервые описано J.Campbell в 1932 г. у пяти фермеров, у которых наблюдалось развитие острых респираторных симптомов после работы с влажным заплесневелым сеном. Эта форма заболевания получила название «легкие фермера». В настоящее время доказано, что это поливалентная аллергия, вызываемая в первую очередь спорами грибов, а во вторую и третью - пыльцой растений и клещами домашней пыли.
Этиологические факторы, вызывающие развитие профессионального ЭАА, можно разделить на несколько групп:
1) микроорганизмы (бактерии, термофильные актиномицеты, грибы, простейшие) и продукты их жизнедеятельности (эндотоксины, белки, глико- и липопротеиды, полисахариды, ферменты);
2) биологически активные субстанции животного (сывороточные белки, шерсть животных и пр.) и растительного происхождения (опилки деревьев, заплесневелая солома, экстракты кофейных зерен);
3) низкомолекулярные соединения (тяжелые металлы и их соли, диизоцианат толуола, тримелитиковый ангидрид и др.), а также многие лекарственные препараты (антибиотики, интал, нитрофураны, антиметаболиты, антимитотические препараты, ферменты, гормоны и др.).
Ведущими причинными агентами являются термофильные актиномицеты - бактерии размером менее 1 мкм, обладающие морфологическими свойствами грибов, которые широко встречаются в почве, компосте, воде, в кондиционерах. Наиболее частыми видами термофильных актиномицет, ассоциированными с экзогенным аллергическим альвеолитом, являются Мicropolyspora faeni, Thermoactinomyces vulgaris, Thermoactinomyces viridis, Thermoactinomyces saccharis, Thermoactinomyces candidum. Данные микроорганизмы размножаются при температуре 50-600С, то есть в тех условиях, которые достигаются в отопительных системах или при гниении органического материала. Термофильные актиномицеты ответственны за развитие «легких фермера», багассоза (заболевание легких у работающих с сахарным тростником), «легких лиц, выращивающих грибы».
Различные виды Aspergillus связаны с развитием таких заболеваний, как «легкие варщиков солода», «легкие сыроваров», субероз (болезнь, развивающаяся у работающих с корой пробкового дерева). Aspergillus fumigatus может стать причиной развития альвеолита у городских жителей, так как является частым обитателем сырых непроветриваемых теплых помещений.
Описаны случаи ЭАА у зерноводов, тростниководов, хлопкоробов и хлопкопереработчиков, табаководов, мукомолов, сыроделов, скорняков, обувщиков, шлифовальщиков риса, производителей пеньки, рабочих овощехранилищ, зернохранилищ, кофейных плантаций, изготавливающих солод, лекарственные препараты, в этиологии которых важная роль отводится истинным грибам, термофильным и другим бактериям, бактериальным продуктам (эндотоксинам, гликопротеидам), животным белкам, белкам рыбы, водорослей, растительной пыли.
К ЭАА относится и биссиноз — профессиональное заболевание легких у рабочих, занятых обработкой естественных волокнистых веществ (хлопка, льна, пеньки, древесины, агав и др.) при ингаляции растительной пыли. Большую роль в развитии биссиноза отводят сочетанному воздействию растительной пыли и бактериальных эндотоксинов. В прицветниках хлопка, в волокнах льна, пеньки обнаружены грамотрицательные бактерии, плесени (кладоспоры, альтернарии, аспергиллы, споротрихии и др.). Также ЭАА регистрируется у виноградарей при переработке винограда, у рабочих, занятых на переработке сладкого перца.
Возможно развитие ЭАА у работников, контактирующих с пластмассами, полиуретаном, смолами, красителями. Наибольшее значение имеют диизоцианаты, фталиковый ангидрит. Известны случаи ЭАА при воздействии солей тяжелых металлов (хрома, кобальта, золота, мышьяка, меди, бериллия), при воздействии инсектицидов, особенно при использовании сульфата меди для опрыскивания фруктовых деревьев, виноградников, томатов, при воздействии соединений диизоцианата (диизоцианат толуола, диизоцианат гексаметилена, диизоцианат дифенилметана), широко применяемых в автомобильной, резиновой, лакокрасочной промышленности, в производстве полиуретанов.
ЭАА, вызванный низкомолекулярными соединениями, описан у рабочих фармацевтических предприятий, а также у больных при использовании лекарственных средств, особенно животного происхождения, чаще в виде спреев, например из гипофиза крупного рогатого скота (питуитрин, адиурекрин), применяемых в виде ингаляции при лечении несахарного диабета. Особенно тяжелые случаи ЭАА описаны у рабочих производства пепсина, трипсина, антибактериальных препаратов (пенициллина, стрептомицина, амиодарона), антимитотических препаратов (метотрексата, азатиоприна, 6-меркаптопурина) и др.
Патогенез развития ЭАА, вызванного лекарственными препаратами, авторы связывают как с иммунными механизмами, вследствие формирования антигена при соединении гаптена с белками сыворотки крови, бронхоальвеолярного секрета, так и с токсическим воздействием препаратов, особенно на слизистую оболочку бронхоальвеолярного дерева с последующим выделением биологически активных веществ (простагландинов, кининов, лизосомальных ферментов и др.).
Подобный механизм отмечается и при воздействии других химических веществ окружающей и производственной среды. Механизм индукции системных иммунных и локальных токсических реакций имеет место и при ЭАА, вызванном ангидридом тримелитиковой кислоты у рабочих, занятых на производстве пластмасс, резины, красок.
Для всех видов ЭАА, обусловленного действием химических соединений, наряду с развитием иммунных реакций характерно наличие различных токсических поражений (локальных и общих). При данном типе ЭАА почти всегда обнаруживаются антитела к комплексам (соответствующее химическое соединение - белок). Выявляются при этом как IgG, так и ^Е-антитела той же специфичности. Во многих случаях профессиональное заболевание «легкие фермера» вызывают термофильные актиномицеты. К термофильным актиномицетам относятся Micropolyspora faeni, Thermoactinomyces vulgaris, Т. saccharrii, Т. viridis, Т. candidus. Традиционными источниками антигенов бывают заплесневевшее сено, силос и зерно.
У большинства больных с «легкими фермера» были обнаружены преципитирующие антитела к экстрактам заплесневевшего сена, в результате чего было высказано предположение о том, что ЭАА представляет собой сложную иммуноопосредованную реакцию. Результаты последующих исследований подтвердили роль клеточно-опосредованной аллергии в заболевании. Ранняя (острая) реакция организма сходна с реакцией образования иммунных комплексов в легких и характеризуется увеличением числа полиморфноядерных лейкоцитов в альвеолах и мелких дыхательных путях. Она сопровождается проникновением одноядерных клеток в ткань легкого и образованием гранулем. Последующие процессы проявляются в классической форме реакции гиперчувствительности замедленного типа при повторном вдыхании антигенов и адъювантно-активных веществ.
Большинство авторов придерживается точки зрения, что основную роль в патогенезе ЭАА играют иммунокомплексные аллергические реакции (3-й тип по классификации Джелла - Кумбса), хотя возможны аллергические реакции и другого типа (цитотоксического или замедленного). Циркулирующие иммунные комплексы и специфические антитела активируют систему комплемента и альвеолярные макрофаги. Последние выделяют ИЛ-2, хемотаксические факторы, протеолитические ферменты, активные кислородные радикалы, способствуют росту фибробластов, продукции коллагена. В результате развивается альвеолобронхиолит, происходит образование гранулем, фиброзирование интерстиция легких.
Клиника. Течение болезни индивидуально и зависит от частоты и интенсивности воздействия антигена, а также от других особенностей организма. Различают острый, подострый и хронический ЭАА. Характер течения определяется длительностью контакта с антигеном: интермиттирующий контакт с антигеном ведет к острым реакциям, длительный - к хроническому прогрессирующему процессу, когда чрезвычайно трудно заподозрить его аллергический генез.
При острой форме кашель, повышение температуры тела, озноб, недомогание и одышка появляются через 6-8 часов после воздействия антигена и исчезают обычно через несколько дней, если прекращается его воздействие. Острый ЭАА возникает при кратковременном действии антигенов органической пыли в высоких концентрациях. Развитие болезни возможно по пневмониеподобному варианту: на первый план выходит выраженная одышка, в легких прослушиваются крепитация, хрипы. При элиминации антигена в течение нескольких дней больные выздоравливают. Возможен также астмоидный вариант ЭАА, при котором через 15-20 минут после контакта с соответствующим антигеном наблюдается клиническая картина, весьма сходная с таковой при приступе БА: явления удушья, в легких выслушиваются свистящие хрипы, после разрешения приступа выделяется серозная мокрота. Для любых вариантов острого течения ЭАА характерным является «симптом понедельника» (эффект элиминации): за выходные дни (если антиген связан с профессиональной деятельностью) состояние больного улучшается, практически исчезают жалобы и клинические проявления, а в первый же день выхода на работу всё возобновляется.
Изменения на рентгенограммах появляются только после частых повторных контактов с органической пылью, при этом их выраженность зависит от тяжести заболевания. Если на начальной стадии наблюдаются обширные затемнения легочных полей, то в дальнейшем — множественные мелкие очаговые тени или сетчато-узелковое поражение на фоне диффузного пневмосклероза.
Подострая форма протекает скрыто в течение нескольких недель после воздействия, проявляясь кашлем и одышкой, и может прогрессировать до появления цианоза и нарушения дыхания, когда требуется госпитализация больного. Иногда подострая форма может развиться после острой, особенно при продолжающемся воздействии аллергена. У многих больных с острой и подострой формой субъективные и объективные признаки болезни исчезают через несколько дней, недель или месяцев после прекращения воздействия вредного фактора. В противном случае болезнь может перейти в хроническую форму, но частота подобной трансформации неизвестна.
Хроническая форма заболевания может быть представлена постепенно прогрессирующей интерстициальной болезнью легких, сопровождающейся кашлем и одышкой при физической нагрузке без предшествующих проявлений острой или подострой формы. Постепенное начало заболевания происходит, как правило, при воздействии низких доз антигена. Хронический экзогенный аллергический альвеолит обычно возникает при длительном контакте с антигенами чаще органической пыли в небольших дозах с постепенным нарастанием одышки, продуктивного кашля, похудения. При аускультации в легких выслушиваются мелко- и среднепузырчатые влажные хрипы, ослабленное дыхание, при перкуссии определяется коробочный оттенок звука. В дальнейшем у больных развивается легочная и легочно-сердечная недостаточность, обычно с неблагоприятным прогнозом.
«Метотрексатовое легкое» может развиться при любой продолжительности приема препарата, но риск возникновения пневмопатий выше в течение 1-го года терапии. Вместе с тем имеются данные о формировании «метотрексатового легкого» только через 5 лет от начала терапии. При этом тяжесть течения заболевания не зависит от длительности приема и дозы метотрексата. Чаще всего пневмопатия, обусловленная метотрексатом, характеризуется подострым течением (недели от начала приема), реже - острым (дни) и хроническим (месяцы). К факторам риска «метотрексатового легкого» относят диабет, гипоальбуминемию, поражения легких при ревматоидном артрите, пожилой возраст. Легочные изменения при метотрексатовой пневмопатии носят диффузный характер либо преобладают в нижних отделах. Возможны разные патогистологические варианты «метотрексатового легкого»: гиперчувствительный пневмонит, острая интерстициальная пневмония, организующаяся пневмония, эозинофильная пневмония и др. Кроме того, у 20% больных регистрируются эозинофильный васкулит и поражения легких гранулематозного характера.
Клинические признаки «метотрексатового легкого» малоспецифичны и проявляются у большинства пациентов сухим кашлем, одышкой, лихорадкой. Симптоматика на начальном этапе заболевания может опережать его рентгенологические проявления, которые в течение первых недель могут отсутствовать. Затем поражение легких быстро прогрессирует с возникновением плотных диффузных альвеолярных затемнений и снижением легочного объема. Диагностические признаки «метотрексатового легкого» включают следующие критерии: прогрессирующая одышка, лихорадка свыше 380С, тахипноэ более 28 в минуту, наличие признаков интерстициальных изменений при лучевой диагностике, лейкоцитоз, отрицательные результаты бактериологических исследований крови, мокроты и жидкости БАЛ на микрофлору, рестриктивные нарушения функции внешнего дыхания со снижением диффузионной способности легких, PaO2<50 мм рт.ст., верификация интерстициального легочного процесса с помощью биопсии. Диагноз «метотрексатового легкого» считается определенным при наличии не менее 6 из перечисленных выше критериев, вероятным и возможным - при наличии 5 или 4 критериев соответственно.
«Амиодароновое легкое». Амиодарон - антиаритмический препарат с доказанной легочной токсичностью. Последняя обусловлена нарушением нормального метаболизма эндогенных фосфолипидов, которые на фоне длительного приема амиодарона накапливаются в легочной ткани. Особенности фармакокинетики амиодарона обусловливают характерный для него профиль легочной токсичности, что во многом связано с очень длительным периодом полувыведения - в течение 6-12 месяцев. Поэтому для «амиодаронового легкого» в подавляющем большинстве случаев типично медленное начало, вялотекущее улучшение после отмены препарата, возможное развитие или рецидив симптомов после прекращения приема.
Хотя острое повреждение легких при приеме амиодарона в целом не характерно, тем не менее, оно может развиться через несколько дней после внутривенного введения высоких доз препарата. Случаи острого «амиодаронового легкого» описаны после оперативных вмешательств на сердце или легких. Наркоз, оксигенотерапия и механическая вентиляция являются дополнительными факторами риска острого «амиодаронового легкого». Оно манифестирует одышкой, тяжелой гипоксемией, картиной острого РДС, диффузными альвеолярными и интерстициальными затемнениями. Смертность при остром «амиодароновом легком» достигает 40-50%, несмотря на отмену препарата и глюкокортикостероидную терапию. Хроническая форма «амиодаронового легкого» развивается примерно у 0,1% пациентов, получающих низкие дозы, и у 50% больных, использующих высокие дозы препарата. Поражение легких, вызванное амиодароном, развивается во временном интервале от несколько недель до нескольких лет терапии данным ЛС (в среднем через 18-24 месяца).
Обычно «амиодароновое легкое» проявляется одышкой, сухим кашлем, потерей массы тела, недомоганием, умеренной лихорадкой и иногда плевральным болевым синдромом. При аускультации часто обнаруживаются крепитация и влажные хрипы в легких. Среди лабораторных показателей могут иметь место лейкоцитоз и увеличение уровня лактатдегидрогеназы, что может даже предшествовать клиническим симптомам. В качестве дифференциально-диагностического критерия «амиодаронового легкого» и кардиогенного отека легких, часто встречающегося у данной категории больных, может использоваться уровень мозгового натрийуретического пептида.
Диагностика. Диагноз ЭАА устанавливают на основании:
- анамнеза: указания на наличие профессионального антигена, его определенной экспозиции, установление связи между его действием и клинической симптоматикой;
- объективного обследования: аускультативные данные, признаки дыхательной недостаточности при хроническом течении;
- кожного тестирования с некоторыми антигенами;
- при исследовании функции внешнего дыхания: для всех форм ЭАА характерны рестриктивный тип дыхательных нарушений со снижением легочных объемов, диффузионной способности и податливости легких, а также гипоксемия после физической нагрузки, а затем и в покое.
Скорость развития дыхательных нарушений зависит от формы заболевания. В высокоспециализированных учреждениях можно исследовать диффузионную способность легких, которая является весьма чувствительным индикатором при ЭАА. При ранних стадиях заболевания, как правило, наблюдается нормальное напряжение О2 в артериальной крови, однако уже отмечается снижение сатурации во время физической нагрузки. При хронической форме заболевания наиболее характерным изменением является снижение статических объемов легких. Иногда при хронических изменениях описывают повышение комплаенса и снижение эластической отдачи, что характерно для обструкции дыхательных путей при эмфиземе. Функциональные легочные пробы при всех формах свидетельствуют об уменьшении объема легких, нарушении диффузионной способности, снижении эластичности, гипоксии при физической нагрузке. Важными критериями прогрессирования хронической формы болезни становятся изменения, свидетельствующие об обструкции дыхательных путей.
На рентгенограмме грудной клетки типичные признаки отсутствуют. Изменения на рентгенограммах появляются только после частых повторных контактов с органической пылью, при этом выраженность этих изменений зависит от тяжести заболевания. На начальной стадии наблюдается обширное затемнение легочных полей, в дальнейшем — множественные мелкие очаговые тени или сетчато-узелковое поражение. Если эти изменения наблюдаются не более 1 года, то при устранении контакта с органической пылью они полностью исчезают. При острой и подострой формах может отмечаться снижение прозрачности легочных полей по типу «матового стекла», нечеткие пятна, диффузные или отдельные узелковые инфильтраты; при хронической форме появляется сеть диффузных узелковых инфильтратов, а также такие нарушения, как плевральный выпот, уплотнение или прикорневая аденопатия; при далеко зашедших стадиях - картина «сотового легкого».
Рентгеновская компьютерная томография. Благодаря большой разрешающей способности КТ значительно потеснила линейную томографию. Тонкие срезы органов грудной клетки, компьютерная обработка информации, выполнение исследования в сжатые сроки (10-20 секунд) устраняют артефакты, связанные с дыханием, передаточной пульсацией и т.д., а возможность контрастного усиления позволяет значительно улучшить качество КТ-изображения на аппаратах последних поколений. Объемная реконструкция дает представление о бронхолегочной системе в режиме виртуальной реальности. Относительный недостаток КТ - высокая стоимость исследования по сравнению с обычными рентгеновскими методами. КТ с высоким разрешением выявляет множественные мелкие очаговые тени на фоне сетчатой перестройки легочного рисунка. КТ позволяет выявлять невидимые при обычной рентгенографии узелковые затемнения, зоны «матового стекла», «сотовые изменения». Это исследование показано в тех случаях, когда изменения на рентгенограммах грудной клетки незначительны, а данные физикального исследования свидетельствуют о поражении легких.
Магнитно-резонансная томография применяется при ЭАА для дифференциальной диагностики с сосудистыми поражениями легких.
При «амиодароновом легком» компьютерная томография позволяет визуализировать выраженную плотность и уменьшение объема чаще верхней доли правого легкого, а также контрлатеральное снижение прозрачности. Иногда могут встречаться одиночные или множественные субплевральные участки поражения легочной ткани и соответствующее им утолщение плевры. Реже встречаются двусторонние апикальные образования по типу формирования неоднородных узлов. Вероятность диагноза значительно возрастает при наличии документированной нормальной рентгенографии легких до назначения препарата и развитии легочного фиброза на фоне терапии амиодароном или после ее прекращения. Безусловно, что при этом должны исключаться и другие потенциальные причины легочных изменений.
При лабораторном исследовании при остром воздействии антигена выявляются нейтрофилия и лимфоцитопения.
При всех формах болезни могут повышаться СОЭ, уровень С-реактивного протеина, ревматоидного фактора и иммуноглобулинов в сыворотке крови.
Эозинофилия выявляется редко и часто является незначительной. У большинства пациентов отмечаются нормальные значения СОЭ, однако в 31% случаев этот показатель достигает 20-40 мм/ч, в 8% - превышает 40 мм/ч. Часто выявляют повышенные уровни общих IgG и IgM, иногда также увеличено содержание общего IgA в сыворотке крови. У некоторых пациентов обнаруживают умеренное повышение активности ревматоидного фактора. Особое значение при экзогенном аллергическом альвеолите имеет обнаружение специфических преципитирующих антител к «виновному» антигену (методами двойной диффузии, встречного иммуноэлектрофореза и им-муноферментными методами).
Диагностический бронхоальвеолярный лаваж обеспечивает получение бронхоальвеолярного смыва, или жидкости бронхоальвеолярного лаважа (БАЛ) у больных при заболеваниях легких. Жидкость БАЛ содержит клеточные элементы, белковые и другие компоненты. Для цитологического исследования ее получают после введения 50 мл подогретого до 370С стерильного изотонического раствора натрия хлорида. В стерильную ареактогенную посуду отсасывается не менее 10 мл материала, который немедленно подвергается исследованию. Выделенные из жидкости БАЛ клетки отмывают в растворе Хенкса общепринятым методом. После подсчета количества клеток пробирочным методом в камере Горяева готовят мазки, которые окрашивают по Романовскому - Гимзе. На 300 клетках мазка определяют процентное соотношение отдельных клеточных элементов (нейтрофилов, макрофагов, эозинофилов, лимфоцитов и т.д.). При экзогенном аллергическом альвеолите можно выявить увеличенное в 5 раз содержание Т-лимфоцитов (преимущественно CD8+).
Цитологический состав жидкости БАЛ при «амиодароновом легком» широко варьирует от нормальных показателей до высокого содержания нейтрофилов и/ или лимфоцитов. Однако обнаружение в цитограмме БАЛ пенистых макрофагов с высокой степенью вероятности указывает на диагноз «амиодаронового легкого».
Биопсия легкого показана, если для постановки диагноза недостаточно других критериев. Обычно сначала ее производят трансбронхиально, но в некоторых случаях возникает необходимость в открытой биопсии, поскольку она обеспечивает получение более адекватных данных. Несмотря на то что гистологические изменения довольно типичны, они не патогномоничны. Если биоптат получают в активной фазе болезни, в нем определяют интерстициальный альвеолярный инфильтрат, состоящий из плазматических клеток, лимфоцитов, иногда эозинофилов и нейтрофилов, и гранулемы. Как правило, выявляют интерстициальный фиброз, но на ранних стадиях болезни он слабо выражен.
Частым признаком экзогенного аллергического альвеолита являются неказифицирующиеся гранулемы, которые могут быть обнаружены в 67-70% случаев. Эти гранулемы отличаются от таковых при саркоидозе: они меньше по размеру, менее четко очерчены, содержат большее количество лимфоцитов и сопровождаются распространенными утолщениями альвеолярных стенок, диффузными лимфоцитарными инфильтратами. Элементы органического материала обычно отсутствуют, иногда могут выявляться небольшие фрагменты инородных частиц.
Возможно наличие гигантских клеток и телец Шаумана, но оно неспецифично для ЭАА. Гранулемы обычно разрешаются в течение 6 месяцев при отсутствии повторного контакта с антигеном. Характерным признаком заболевания является альвеолит, основные воспалительные элементы которого - лимфоциты, плазматические клетки, моноциты и макрофаги. Пенистые альвеолярные макрофаги преобладают в люминальных отделах, то есть внутри альвеол, в то время как лимфоциты - в интерстиции. На ранних стадиях ЭАА может быть обнаружен интраальвеолярный фибринозный и белковый выпот.
Возможно также развитие облитерирующего бронхиолита, перибронхиальных воспалительных инфильтратов, лимфатических фолликулов. Гранулематоз, альвеолит и бронхиолит составляют так называемую триаду морфологических признаков при ЭАА, при этом все элементы находят не всегда. Васкулит при ЭАА встречается крайне редко (обычно при неблагоприятном исходе заболевания).
При повышении давления в легочной артерии отмечается гипертрофия медии артерий и артериол. При хроническом течении ЭАА обнаруживают фибротические изменения, выраженные в различной степени. Иногда фиброз ассоциирован с умеренной лимфоцитарной инфильтрацией, плохо очерченными гранулемами, в этом случае диагноз ЭАА также можно предположить по данным морфологического исследования. Однако гистологические изменения при хронической форме заболевания часто не отличаются от таковых при других хронических интерстициальных заболеваниях легких. Так называемый неспецифический легочный фиброз может быть конечным проявлением универсальных реакций на повреждающий фактор при этих заболеваниях. При далеко зашедших стадиях отмечаются изменения архитектоники легочной паренхимы по типу «сотового легкого».
Дифференциальная диагностика.
Хроническую форму ЭАА необходимо дифференцировать с интерстициальными болезнями легких различной природы.
В НИИ пульмонологии С.-Петербургского государственного медицинского университета им. И.П.Павлова была создана классификация интерстициальных болезней легких, согласно которой все патологические процессы, проявляющиеся рентгенологическим синдромом легочной диссеминации, разделены на пять групп:
Фиброзирующие альвеолиты (идиопатические, экзогенные аллергические, токсические, фиброзирующие альвеолиты как синдром диффузных болезней соединительной ткани, хронического активного гепатита и др.).
Гранулематозы легких (саркоидоз легких, гистиоцитоз X легких, диссеминированный туберкулез легких, пневмокониозы, пневмомикозы и др.).
Системные васкулиты (при диффузных болезнях соединительной ткани: узелковый периартериит, гранулематоз Вегенера и другие некротизирующие ангииты; при идиопатическом гемосидерозе легких и синдроме Гудпасчера).
Группа так называемых болезней накопления (альвеолярный протеиноз, альвеолярный микролитиаз, первичный амилоидоз легких, кальцификация (оссификация) легких).
Легочные диссеминации опухолевой природы (бронхиолоальвеолярный рак, карциноматоз первичный и метастатический; поражение легких при лимфогранулематозе, лейкозах; лейомиоматоз легких).
Тщательный анализ анамнеза, эффективность проводимой терапии, отсутствие системных нарушений позволяют исключить лекарственную аллергию и коллагеноз. В некоторых случаях для того, чтобы дифференцировать хроническую форму ЭАА от идиопатического легочного фиброза, требуется биопсия легкого.
Изменения в легких в острую и подострую фазу сходны с изменениями при других болезнях, сопровождающихся системными проявлениями и рецидивирующими легочными инфильтратами. К таким заболеваниям относятся коллагенозы, лекарственная аллергия, аллергический бронхолегочный аспергиллез и другие эозинофильные пневмонии. Эозинофильная пневмония часто связана с астмой и характеризуется периферической эозинофилией: ни то, ни другое не выявляется при ЭАА. Аллергический бронхолегочный аспергиллез часто путают с альвеолитом, так как находят преципитирующие антитела к аспергиллам.
Острую и подострую формы заболевания дифференцируют от аллергического пневмомикоза и, прежде всего, от аллергического бронхолегочного аспергиллеза и других видов легочной эозинофилии, поскольку для этих заболеваний также характерны выраженные общие симптомы и «летучие» легочные инфильтраты. Легочная эозинофилия часто сочетается с бронхиальной астмой и всегда сопровождается эозинофилией крови. Аллергический бронхолегочный аспергиллез часто путают с ЭАА из-за наличия преципитирующих антител к Aspergillus fumigatus. В отличие от ЭАА аллергический бронхолегочный аспергиллез всегда сочетается с аллергической бронхиальной астмой, для него характерен обструктивный тип дыхательных нарушений.
Определенную трудность представляет дифференциальная диагностика острой формы заболеваний с токсическим синдромом, вызванным органической пылью и пневмомикотоксикозом. Токсический синдром, вызванный органической пылью встречается гораздо чаще, чем ЭАА. Он развивается после вдыхания чрезвычайно большого количества органической пыли и проявляется миалгией, лихорадкой, ознобом, кашлем и затемнениями легочных полей, которые появляются спустя несколько часов после контакта. Возбудителями считают плесневые грибы рода Aspergillus, однако преципитирующие антитела к ним у больных не выявляются. Симптомы поражения легких наблюдаются не всегда.
Хроническую форму ЭАА дифференцируют от саркоидоза, ХОБЛ, легочных проявлений при системных заболеваниях соединительной ткани. Последние обычно можно исключить на основании анамнеза, физикального и лабораторного исследования.
Верификацию саркоидоза осуществляют на основании гистологического исследования биоптатов пораженных органов. Достаточно информативным методом (80%) является трансбронхиальная внутрилегочная биопсия, позволяющая получить для гистологического исследования фрагмент легочной ткани. Более информативны (до 95%), но и более травматичны медиастиноскопия и медиастинотомия. Известен и другой специфический метод подтверждения диагноза саркоидоза - проба Квейма, предложенная в 1941 г. Гомогенат ткани пораженного лимфоузла или селезенки больного саркоидозом (антиген Квейма) вводят обследуемому внутрикожно. В месте введения через месяц формируются саркоидные гранулемы, которые обнаруживают при гистологическом исследовании иссеченного участка кожи. Информативность метода составляет 60-70%. В настоящее время проба Квейма используется редко в связи со сложностью, длительностью и опасностью переноса инфекции.
Владислав КОСАРЕВ, заведующий кафедрой профессиональных болезней и клинической фармакологии, доктор медицинских наук, профессор, заслуженный деятель науки РФ.
Александр ЖЕСТКОВ, заведующий кафедрой общей и клинической микробиологии, иммунологии и аллергологии, доктор медицинских наук, профессор.
Сергей БАБАНОВ, доцент кафедры профессиональных болезней и клинической фармакологии, доктор медицинских наук.
Самарский государственный медицинский университет.
Лекарственные поражения легких - неоднородная группа болезней, возникающих в ответ на прием лекарственных препаратов.
Выделяют следующие формы лекарственных поражений легких:
1) альвеолит (экзогенный аллергический и токсический) ;
2) бронхиальная астма;
3) легочная эозинофилия;
4) респираторный дистресс-синдром;
5) легочная гипертония и тромбоэмболии легочных артерий.
Альвеолит
Этиология и патогенез
Экзогенный аллергический альвеолит развивается в результате приема лекарственных препаратов, обладающих выраженными аллергизирующими свойствами, - антибиотиков, сульфаниламйдов, гормонов (инсулин, АКТГ), ферментов (трипсин, химотрипсин, стрептокиназа), сывороток, контрастных веществ. Некоторые из них являются самостоятельными антигенами, другие выступают в роли гаптенов и соединяются с белками организма. Антигены образуют с антителами растворимые иммунные комплексы, которые фиксируются на стенках сосудов легких и вызывают их повреждение. При продолжении воздействия антигена включаются реакции клеточного иммунитета, что ведет к появлению эпителиоидно-клеточных гранулем и постепенному нарастанию фиброза. Морфологические изменения в паренхиме легких при лекарственном аллергическом альвеолите неотличимы от таковых при экзогенном аллергическом альвеолите другой природы. Многие лекарственные препараты оказывают прямое токсическое действие на легочную ткань, вызывая развитие токсического альвеолита. Такое действие оказывают следующие препараты: цитостатики (метотрексат, хлорбутин, меркаптопурин, азатиоприн, миелосан, винкристин); противоопухолевые (блеомицин); производные нитрофурана (фурагин, фурадонин); пероральные противодиабетические (хлорпропамид); сульфаниламиды; ганглиоблокаторы (бензогексоний); Р-адреноблокаторы (пропранолол); противоаритмические (токаинид, дифенин, кордарон). Сходные изменения в легких вызывают некоторые токсичные вещества, которые применяют на производствах, - раздражающие газы (хлор, аммиак, сероводород), пары металлов (бериллий, никель, цинк и др.), гербициды, пластмассы. Лекарственные препараты, в частности цитостатики, вызывают некроз эндотелия капилляров и альвеол, нарушение микроциркуляции, отек интерстиция с последующим развитием фиброза. В отличие от экзогенного аллергического альвеолита вероятность развития токсического альвеолита зависит от дозы препаратов и длительности лечения. Особенно велик риск его при проведении комбинированной химиотерапии.
Клиника
Симптомы лекарственного аллергического альвеолита сходны с симптомами экзогенного аллергического альвеолита другой этиологии. Заболевание нередко начинается остро: через несколько часов после попадания лекарственного препарата в дыхательные пути, перорального его приема или парентерального введения появляются лихорадка с ознобом, кашель со слизистой мокротой, одышка, иногда приступы удушья, артралгии и миалгии, головные боли. При аускультации обнаруживают мелкои среднепузырчатые хрипы с обеих сторон, крепитацию, а при наличии бронхоспазма сухие свистящие хрипы. В крови наблюдаются лейкоцитоз, увеличение числа эозинофилов, СОЭ, на рентгенограммах - усиление легочного рисунка, очаговая диссеминация и участки инфильтрации легочной ткани. После прекращения контакта с антигеном все симптомы могут быстро исчезнуть без какого-либо лечения. При постоянном воздействии небольших доз антигена заболевание приобретает хроническое течение, одышка нарастает постепенно, крепитация в легких более грубая. Изменения в крови могут отсутствовать. Рентгенологически отмечаются нарастающие усиление и деформация легочного рисунка. При исследовании функции внешнего дыхания прежде всего отмечают снижение ЖЕЛ. ОФВ1 может также быть снижена за счет сопутствующего бронхоспазма.
Клиническая картина лекарственного токсического альвеолита сходна с таковой при экзогенном аллергическом альвеолите. Риск развития его наиболее высок в онкологических, гематологических и других стационарах, где широко используют цитостатики, а также у больных с заболеваниями мочевыводящих путей, получающих препараты нитрофурана. Поражение легких развивается обычно при длительном лечении и чаще протекает хронически. Наряду с кашлем и прогрессирующей одышкой больные жалуются на слабость, субфебрилитет, боли в грудной клетке, похудание. Интервал между началом приема лекарственных средств и проявлением их токсического действия на легочную ткань зависит от вида препарата и индивидуальной чувствительности больного.
Диагноз и дифференциальный диагноз
Диагноз лекарственного альвеолита, как экзогенного аллергического, так и токсического, основывается прежде всего на тщательном анализе клинических данных. Он несложен при появлении симптомов альвеолита через короткое время после приема лекарственного препарата и быстром их исчезновении после его отмены. При хроническом течении установить лекарственную этиологию заболевания бывает труднее. В первую очередь лекарственный альвеолит следует подозревать у больных, длительно получающих различные препараты, токсическое действие которых на паренхиму легких хорошо известно. Клинические проявления лекарственного альвеолита мало отличаются от таковых при идиопатическом фиброзирующем альвеолите, однако можно выделить и некоторые их особенности, в частности нередкое наличие бронхоспастического синдрома, эозинофилии, других проявлений лекарственной болезни (гепатит, кожные высыпания, гломерулонефрит и др.). Обострения заболевания наблюдаются на фоне очередного применения лекарственных препаратов. Для выявления специфического антигена у больных лекарственным аллергическим альвеолитом используют реакции преципитации, торможения миграции лейкоцитов и бласттрансформации лимфоцитов. Провокационные пробы с ингаляционным или подкожным введением лекарственных средств необходимо проводить с крайней осторожностью. При наличии лекарственного алергического альвеолита контакт с антигенами ухудшает самочувствие больных, вызывает повышение температуры тела, снижение ЖЕЛ.
Бронхиальная астма
Этиология и патогенез
Развитие заболевания может быть обусловлено различными механизмами: 1) повышенной чувствительностью к лекарственному препарату; 2) непереносимостью нестероидных противовоспалительных средств; 3) побочным действием лекарственных препаратов, оказывающих бронхоспастическое действие. Повышенная чувствительность к лекарственному препарату (аллергическая бронхиальная астма). Лекарственная бронхиальная астма может быть вызвана приемом любых лекарственных средств, особенно при ингаляционном и парентеральном их применении. Возникновение бронхоспазма наблюдают и при систематическом контакте с лекарственными веществами (у медицинских сестер, работников фармацевтических предприятий). Наиболее распространенными этиологическими факторами являются антибиотики (пенициллин, стрептомицин, тетрациклин), сульфаниламиды, производные йода, витамины группы В. Бронхиальная астма, связанная с лекарственной аллергией, является одной из форм атопической бронхиальной астмы и имеет сходные с ней механизмы развития. Непереносимость нестероидных противовоспалительных средств («аспириновая» астма). Основой патогенеза «аспириновой», или простагландиновой, бронхиальной астмы является нарушение метаболизма арахидоновой кислоты под влиянием нестероидных противовоспалительных средств, которые блокируют его циклооксигеназный путь и повышают вероятность липооксигеназного. В процессе последнего образуются лейкотриены С и D, обладающие выраженным бронхоконстрикторным действием. Кроме того, при этой форме астмы снижается соотношение уровней простагландинов Е2 и F2a за счет увеличения последнего, который, как и лейкотриены, является медиатором бронхоспазма. Побочное действие лекарственных веществ. Бронхоспастическое действие, не связанное с аллергией, оказывают некоторые лекарственные препараты, в том числе p-адреноблокаторы (пропранолол и др.), холиномиметики (ацетилхолин, неостигмин), опиаты, высвобождающие гистамин, симпатолитические средства (резерпин, раувазан и др.).
Клиника
Приступы болезни обычно появляются через несколько часов после приема лекарственного препарата и, как правило, сопровождаются другими проявлениями анафилаксии (кожный зуд, крапивница, эритема, отек Квинке, лихорадка с ознобом и т. д.). В крови и мокроте повышены число эозинофилов и уровень иммуноглобулина Е. В некоторых случаях (чаще при постоянном контакте с небольшими дозами антигена) четко связать появление приступов с применением определенного лекарственного вещества не удается. У таких больных может развиться развернутся клиническая картина лекарственной болезни с поражением не только легких, но и других органов (печени, почек, сердца и т. д.). Вероятность лекарственной аллергии повышается в случае полипрагмазии, т. е. одновременного применения большого числа препаратов.
«Аспириновая» астма обычно развивается у больных с полипозной риносинусопатией. Через несколько минут после приема ацетилсалициловой кислоты, бруфена, индометацина или другого препарата этой группы возникают приступы удушья. Непереносимость нестероидных противовоспалительных средств может проявиться в возрасте 30-40 лет у людей, которые раньше принимали эти препараты без каких-либо осложнений. В отличие от аллергической бронхиальной астмы содержание иммуноглобулина Е в крови у таких больных нормальное. Побочное бронхоспастическое действие лекарственных средств чаще наблюдается у больных с исходной бронхиальной гиперреактивностью, например, при необдуманном назначении |3-адреноблокаторов больным с ремиссией хронического обструктивного бронхита или бронхиальной астмы.
Диагноз и дифференциальный диагноз
Критерии диагностики лекарственной аллергической астмы те же, что и атопической астмы другой этиологии. При приеме различных препаратов установить, какой из них является аллергеном (или гаптеном), обычно трудно. Для выявления лекарственной аллергии могут быть использованы провокационные пробы (с крайней осторожностью) и лабораторные методы (реакция дегрануляции базофилов п торможения миграции лейкоцитов). Последние приобретают особое значение при решении вопросов экспертизы трудоспособности у больных с предполагаемой профессиональной лекарственной бронхиальной астмой.
У больных «аспириновой» астмой наблюдается «аспириновая триада» - непереносимость нестероидных противовоспалительных средств, бронхиальная астма и молипозная риносинусопатия. Для подтверждения диагноза используют провокационные пробы с пероральным приемом ацетилсалициловой кислоты - начальная доза 30 мг, через 30 мин 300 мг и через 60 мин еще 600 мг Пробу считают положительной при снижении ОФВ) на 30 % и более. Последующую дозу ацетилсалициловой кислоты можно давать лишь при условии отсутствия резкого ухудшения бронхиальной проходимости при приеме предыдущей.
Легочная эозинофилия
Этиология и патогенез
Причиной образования эозинофильных инфильтратов в легких и развития эозинофильной пневмонии могут быть различные лекарствен ные вещества, в том числе пенициллин и другие антибиотики, сульфаниламиды, производные нитрофурана, ПАСК, метотрексат. При гистологическом исследовании ткани легких обнаруживают массивную эозинофильную инфильтрацию интерстиция, отек альвеол.
Клиника
Эозинофильные инфильтраты (синдром Леффлера) характеризуются появлением лихорадки, непродуктивного кашля, одышки после приема лекарственных препаратов. На рентгенограммах обнаруживают двусторонние участки инфильтрации легочной ткани, в крови эозинофилию, которая может достигать 50-70 %. Иногда лекарственные вещества оказываются пусковым фактором развития эозинофильного васкулита или астматического варианта узелкового периартериита, при которых, помимо легких, поражаются и другие органы.
Диагноз и дифференциальный диагноз
Диагноз основывается на клинических, рентгенологических и лабораторных данных (сочетание двусторонних инфильтратов в легких с высокой эозинофилией крови). Дифференцировать эозинофильную пневмонию приходится от бактериальной. Основными отличительными признаками для первой являются связь заболевания с приемом лекарственных веществ и наличие большого числа эозинофилов в крови. Причиной гиперэозинофилии могут быть также паразитарные инвазии, опухоли, ревматоидный артрит и некоторые другие заболевания.
Респираторный дистресс-синдром
Этиология и патогенез
Причиной развития заболевания могут быть героин, передозировка наркотиков (морфина), производные нитрофурана, ацетилсалициловая кислота, тиазидовые диуретики. Заполнение жидкостью альвеол, обусловленное повышением проницаемости стенок сосудов, ведет к острой дыхательной недостаточности и выраженной артериальной гипоксемии.
Клиническая картина
Характерно появление быстро нарастающей одышки и цианоза через несколько часов после действия повреждающего агента. Аускультативно над всей поверхностью легких определяются влажные мелкои среднепузырчатые хрипы. На рентгенограмме видны диффузное усиление легочного рисунка и множественные инфильтративные тени в легких. РаОг резко снижено. Летальность достигает 50-60 %. В результате лечения возможно полное выздоровление, однако нередко развивается диффузный интерстициальный фиброз легких.
Диагноз и дифференциальный диагноз
Необходимо дифференцировать с отеком легких другой этиологии, прежде всего при застойной сердечной недостаточности.
Легочная гипертензия и тромбоэмболии легочных артерий
К развитию легочной гипертензии и повторных тромбоэмболий легочной артерии предрасполагает прием эстрогенов, которые входят в состав большинства используемых в настоящее время пероральных контрацептивов. Резкое увеличение числа случаев первичной легочной гипертензии было отмечено в 1967-1970 гг. в Швейцарии, ФРГ и некоторых других странах, где широко применялся препарат аминорекс с целью снижения аппетита. Повышение давления в легочной артерии было отмечено у 80 % лиц, получавших этот ппепарат.
«Амиодароновое» легкое. Динамика пневмонита.
Faggioni L, Giusti S, Caproni G, Perrone O, Petruzzi P, Caramella D
Ятрогенные поражения легкихОсложнениями лекарственной терапии (лекарственно-ассоциированные, лекарственно-обусловленные заболевания, ятрогении) считаются новые побочные эффекты, возникающие при использовании лекарств в дозах, рекомендованных для профилактики и лечения заболеваний [1]. К побочному действию лекарственных средств (ЛС) относят разнообразные состояния, отличающиеся по патогенезу и являющиеся неспецифическими [2]. Так, они могут быть обусловлены преимущественно предрасположенностью организма, различными последствиями собственно фармакологического действия лекарств, своеобразием нервно-психических реакций больного. В понятие лекарственной болезни не включены патологические процессы, возникающие в связи с передозировкой лекарственных препаратов, выдачей или приемом по ошибке другого вещества [2].
Впервые лекарственное поражение легких описано W.Osler в 1882 г. у больного с некардиогенным отеком легкого, развившимся в результате приема опиатов [3]. Впоследствии российский ученый Е.А.Аркин в 1901 г., наблюдая за системной реакцией (анорексия, астения, лихорадка, диспепсические расстройства и т.д.), появившейся у больного одновременно с кожной сыпью после втирания серно-ртутной мази, высказал предположение о том, что данный симптомокомплекс вызван воздействием ЛС, и впервые употребил термин "лекарственная болезнь". Большой вклад в изучение клиники и патогенеза лекарственной болезни внес Е.М.Тареев [4].
В 1972 г. Rosenow представил перечень 19 терапевтических ЛС, вызывающих поражение легких, который постоянно пополняется и к настоящему времени включает более 150 ЛС [4]. Представления о легочной патологии лекарственного генеза расширились и в результате совершенствования клинико-инструментальных методов исследования обогатились новыми данными (табл. 1).
Результаты мониторинговых исследований по изучению побочного действия лекарств, проводимых в США, показали, что около 25% всех госпитализаций связано с лекарственной болезненностью [4, 5]. При этом на долю поражений легких как побочного эффекта лекарств приходится до 10% всех ятрогенных осложнений [4–6]. По данным различных авторов, легочные заболевания, вызванные лекарствами, составляют в общей структуре внегоспитальной заболеваемости до 5%, а среди госпитализированных больных до 15% [6, 7]. Хотя побочные эффекты ЛС – неизбежный спутник медикаментозного лечения, их можно предупредить [8]. Однако симптомы лекарственного поражения легких неспецифичны и распознать лекарственную болезнь бывает сложно [9, 10].
В недавних исследованиях показано, что главная причина таких эффектов – неосведомленность о них как врачей, так и больных [8, 9, 11]. Например, известные побочные эффекты кардиотропной терапии, несмотря на кардиоселективность препаратов, сходны с проявлениями бронхообструктивного синдрома [5, 6, 8, 11]. Кашель, усиление одышки у больных хроническими обструктивными болезнями легких расцениваются как обострение основного заболевания, особенно в тех случаях, когда больной уже принимал кардиотропную терапию. Очень затрудняет диагностику позднее проявление ятрогенных заболеваний, например фиброз легких, ассоциированный с длительным приемом блокаторов кальциевых каналов (кордарон, амиодарон, нитрофураны) [12–14]. Для исключения лекарственной причины поражения легких в таких случаях необходима морфологическая верификация диагноза, так как легочная диссеминация бывает рентгенологически неотличима от идиопатической формы фиброзирующего альвеолита [13, 15].
Классификация легочных ятрогенных реакций
Большинство побочных эффектов можно отнести к двум типам [15, 16]. К побочным эффектам первого типа – самым частым – относят чрезмерные реакции на препарат [16]. Ко второму типу относят эффекты, не связанные с основным фармакологическим действием препарата. Они бывают неожиданными и часто довольно тяжелыми. Выделяют следующие варианты лекарственной болезни легких [2, 6, 13]:
• Синдром нарушения дыхания
• Легочная эозинофильная инфильтрация
• Астма
• Облитерирующий бронхиолит
• Интерстициальный пневмонит
• Некардиогенный отек легких
• Легочные васкулопатии
• Лекарственно-индуцированная системная красная волчанка
• Плевральный выпот
Патогенез лекарственного поражения легких
Высокая восприимчивость легких к лекарственному воздействию определяется анатомо-физиологическими особенностями, в первую очередь большим объемом микроциркуляторного русла, а также активным участием в метаболизме азотсодержащих субстанций, алкилировании, гидроксилировании, образовании свободных радикалов [17]. В патогенезе легочной ятрогении особое внимание уделяют свободнорадикальному повреждению из-за высокого кислородного потенциала в легком. Легкие метаболически активны и способны к поглощению, метаболическому изменению фармакологических средств и, следовательно, к концентрации токсических продуктов [18, 19]. Свободные радикалы напрямую и опосредованно участвуют в повреждении легочных структур, прогрессировании пневмосклероза [17]. Под воздействием препаратов и их метаболитов в легком нарушаются секреторные функции эпителия, альвеолярных макрофагов, что приводит к морфологическим изменениям по типу фосфолипидоза [12, 17, 20].
Расстройства акта дыхания могут наступить при глубоком наркозе и возникают вследствие паралича дыхательного центра или бульбарных нарушений, что приводит снижению тонуса мышц мягкого неба, атонии и западанию языка, параличу голосовых связок, ларингоспазму [21, 22]. У таких больных развиваются гиперсаливация и регургитация, которые становятся причиной ателектазов [23] (вопросы острых отравлений, преднамеренных передозировок не рассматриваются).
Связанные с ЛС реакции могут измениться с возрастом пациента или другими коморбидными условиями. Учитывая данные обстоятельства, можно выделить факторы риска побочных реакций лекарств [23, 24]:
• возраст,
• длительность приема,
• дозы,
• наследственная предрасположеность,
• наличие других заболеваний.
Клиническая картина
Установление этиологического диагноза поражения легких, вызванного лекарствами, часто представляет трудности из-за отсутствия специфических клинических и морфологических признаков. Важный этап представляет сбор анамнеза, так как уже на этом этапе можно установить связь появления симптомов с приемом определенного препарата. Следует обратить внимание на сроки и дозы приема препаратов.
Клинические проявления лекарственного поражения легких стереотипны и представлены одышкой при физической нагрузке или в покое, появлением малопродуктивного кашля, при тяжелом течении – приступов удушья, могут наблюдаться кровохарканье, боли при дыхании [24].
При объективном обследовании могут обнаруживаться проявления лекарственной аллергии в виде сыпей. При тяжелой дыхательной недостаточности (некардиогенный отек легких, фиброзирующий альвеолит) наблюдается цианоз [25]. Больным с лекарственной астмой, как правило, свойственно развитие вазомоторного ринита, приступов бронхиальной обструкции вплоть до астматического состояния. Симптомы бронхиальной астмы обычно купируются при отмене препарата, но могут и персистировать, особенно в случае приема препарата на фоне гиперреактивности бронхов [26].
Аускультативная картина зависит от варианта лекарственной легочной патологии. При бронхиальной обструкции (астма, облитерирующий бронхиолит) выслушиваются жесткое дыхание, сухие хрипы. При фиброзирующем альвеолите в базальных отделах легких выслушивается нежная крепитация. При развитии волчаночноподобного синдрома возможно появление шума трения плевры вследствие плеврита [23, 24, 27].
При рентгенологическом исследовании обнаруживают изменения, типичные для того или иного варианта поражения легких. Выраженность рентгенологических изменений коррелирует с тяжестью дыхательных нарушений. Могут обнаруживаться усиление легочного рисунка, летучие эозинофильные инфильтраты, симптом "матового стекла", эмфизема, пневмосклероз [25, 27]. Особенностью интерстициального фиброза в легких является множественная пневмониеподобная инфильтрация. Для подтверждения диагноза необходима биопсия легких [2, 10, 18]. Так как токсические реакции, вызванные лекарствами, значительно усугубляют течение предшествующего заболевания легких, больным при лечении основного заболевания во избежание прогрессирования легочной патологии необходимо назначать селективные препараты [16, 25, 26]. Исследование функции внешнего дыхания регистрирует нарушения по обструктивному или смешанному типу [16, 28]. При бронхиальной астме обнаруживается снижение показателей ПОС 1 с, при интерстициальном фиброзе – снижение преимущественно форсированной жизненной емкости легких. Как правило, показатели функции внешнего дыхания увеличиваются при отмене препарата [22, 29].
Дифференциальный диагноз
Основным диагностическим критерием лекарственного поражения легких является зависимость возникновения симптомов с приемом ЛС. Лекарственный легочный интерстициальный фиброз имеет сходную рентгенологическую семиотику с широким кругом заболеваний, характеризующихся легочной диссеминацией: идиопатический фиброзирующий альвеолит, опухоль легкого. Компьютерная томография не всегда позволяет установить диагноз, поэтому в ряде случаев необходима морфологическая верификация методом биопсии легкого. Значительные трудности представляет дифференциальный диагноз с пневмонией, особенно при ее атипичном течении. Дифференциальный диагноз необходимо проводить с туберкулезом, что обосновывает необходимость проведения тестов на микобактериальную инфекцию. Туберкулиновые пробы могут быть неинформативны, особенно у больных, получавших иммуносупрессивную терапию.
Общие принципы лечения
Лечение лекарственного поражения легких зависит от клинической формы и варианта заболевания. Методы лечения включают прекращение приема препарата, фармакотерапию и десенсибилизацию. Последняя используется редко, в основном для больных с непереносимостью аспирина.
Повышению эффективности терапии способствует обучение пациентов [5, 23]. Больных необходимо информировать о возможных побочных эффектах терапии основного заболевания и способах первой помощи при появлении аллергических реакций на препарат. Больные должны фиксировать режим приема ЛС и своевременно информировать врача о лекарственной непереносимости.
Элиминация этиологического фактора является основным условием лечения при всех формах лекарственных поражений легких [30]. В целом необходимо избегать приема новых препаратов, высокоаллергенных средств, особенно больным с аллергической предрасположенностью. Больной должен знать о лекарственной непереносимости у родственников. Тщательный сбор аллергологического анамнеза позволит избежать возможных побочных реакций на лекарства со стороны легких [22, 24].
Препаратами выбора являются кортикостероиды, режим введения которых определяется тяжестью течения болезни [13]. Лечение центрального паралича дыхательного центра проводится в общепринятом режиме респираторной реанимации.
Легочные лекарственные эозинофилии
Лекарственные легочные эозинофилии могут развиваться после приема любых лекарственных препаратов, чаще всего нитрофуранов, сульфаниламидов, пенициллинов, хлоридамида, тиазидовых диуретиков, трициклических антидепрессантов, гидралазина, изониазида, аминосалициловой кислоты, препаратов золота и др. (табл. 2) [31].
Через некоторое время (в среднем от 2 ч до 10 сут) после приема препарата появляются лихорадка, озноб, сухой кашель, одышка, боли в груди, крапивница, артралгии, гипотензия, очаговые тени или ограниченное затемнение легочных полей, иногда плевральный выпот с большим количеством эозинофилов, в периферической крови – увеличение уровня эозинофилов [32].
Острые аллергические реакции в виде лихорадки, озноба, потоотделения наблюдаются уже при начальном введении цисплатина, блеомицина, метатрексата. Метатрексат-индуцированное поражение легких влечет за собой аллергическую реакцию и приблизительно у половины пациентов не зависит от дозы [33].
При изучении анамнеза определяется четкая зависимость с приемом препарата. При рентгенологическом исследовании обнаруживаются "летучие" инфильтраты, а также признаки пневмонита и плеврального выпота [34]. В периферической крови выявляется эозинофилия. При исследовании жидкости бронхоальвеолярного лаважа обнаруживается увеличение содержания эозинофилов, в ткани легкого – гранулематозное поражение.
Прогноз благоприятный, отмены препарата достаточно для выздоровления.
При дифференциальном диагнозе следует отличать легочную эозинофильную инфильтрацию от кратковременной аллергии, при затяжном течении – от экзогенного аллергического альвеолита.
Лекарственная бронхиальная астма
Бронхоспазм и гиперреактивность дыхательных путей возникают при приеме разнообразных ЛС (табл. 3): пенициллина и его аналогов, b-блокаторов, антагонистов кальциевых каналов, аспирина, нестероидных противовоспалительных средств и т.д. [35]. b-Блокаторы и антагонисты кальциевых каналов, даже кардиоселективные, могут стимулировать бронхоспазм, если применяются парентерально или в больших дозировках [36]. Метахолин, неостигмин или сукцинилхолин имеют холинергические свойства и могут также вызывать бронхоспазм за счет нарушения баланса между холинергическим и адренергическим иннервированием дыхательных путей.
В патогенезе бронхоспазма при приеме аспирина и противовоспалительных лекарств ведущее значение имеют блокада ацетилсалициловой кислотой циклооксигеназного пути метаболизма арахидоновой кислоты и активация "шунтирующего" липоксигеназного пути с образованием лейкотриенов LT C4, LT D4 и LT E4 (комплекс "медленно реагирующей субстанции анафилаксии"), а также наследственная предрасположенность (носительство HLA B35) [37].
Аспирин вызывает триаду симптомов в виде астмы, полипоза носа, гиперчувствительной реакции на препарат [38]. Первые проявления вазомоторного ринита сопровождаются водянистыми выделениями из носа, в последующем присоединяются полипы в носу, и большинство больных с реакцией на ацетилсалициловую кислоту с 20–30-летнего возраста демонстрируют развернутую картину астмы. Такие симптомы, как чиханье, отек слизистой оболочки носа, покраснение лица, диспепсия, появляются через 2 ч после приема аспирина [16, 18].
У 3–20% больных ингибиторы ангиотензинпревращающего фермента (ИАПФ) вызывают сухой ночной кашель и бронхиальную обструкцию, что требует прекращения лечения. Индуцированный лекарствами кашлевой синдром может появляться достаточно быстро уже после нескольких приемов препарата. Но встречается и медленное его развитие – от нескольких месяцев до года [22]. После отмены лечения кашель прекращается в течение 10 дней.
Патогенез АПФ-индуцированного кашля до настоящего времени недостаточно изучен. Известно, что АПФ участвует в метаболизме кининов и субстанции Р. В результате снижения активности АПФ под воздействием лекарств увеличивается концентрация кининов и субстанции Р, раздражающих слизистую оболочку бронхов и обладающих свойствами вазоконстрикции. Другое объяснение заключается в активации обмена арахидоновой кислоты и увеличении концентрации ее метаболитов. Прекращения терапии обычно бывает достаточно для купирования побочного эффекта. У больных с хорошим ответом на препараты, ингибирующие активность АПФ, следует ориентироваться на выбор блокаторов АПФ-рецепторов, не влияющих на обмен кининов.
Бронхоспазм при вдыхании бронхолитиков, особенно аэрозолей натрия кромогликата, беклометазона, адренергическиех средств, относится к категории казуистики. Возможно, такой побочный эффект препарата обусловлен прямым раздражающим действием на дыхательные пути, в том числе за счет способа доставки и содержания в составе ингалятора этанола. Введение высоких доз b-адреномиметиков ингаляторно иногда вызывает парадоксальную b-адренергическую блокаду.
Приступы удушья осложняют введение простагландинов, которые используются в акушерстве и гинекологии для прерывания беременности (мифепристон). Контрастные вещества, вводимые внутривенно, вызывают поражение легких по типу облитерирующего бронхиолита.
Традиционная терапия включает отмену лекарственного средства. В случае развития побочной реакции на аспирин и нестероидные противовоспалительные препараты возможна десенсибилизация. В лечении лекарственной астмы используются кортикостероиды, ингибиторы лейкотриенов и их рецепторов и др.
Облитерирующий бронхиолит
Облитерирующий бронхиолит (ОБ), называемый также "болезнью малых дыхательных путей", или ОБ с организующейся пневмонией (ОБОП), описан поначалу как самостоятельное заболевание [16, 39]. В настоящее время известно, что ОБОП может развиваться как осложнение широкого круга лекарственных и токсических воздействий [25, 29, 40]. Среди причин ОБОП известны нитрофураны, сульфаниламиды, пенициллины, аспирация минеральных масел, наркотики, цитостатики, соли золота; 25% лекарственного ОБОП приходится на амиодароновую токсичность [29, 41]. Появляется все больше данных о легочной токсичности препаратов, регулирующих липидный обмен, в частности симвастатина. Статины вызывают изменения в легких по типу фосфолипидоза. Морфологическая картина легочных поражений, вызванных статинами, имеет сходство с вариантами интерстициальной пневмонии с ОБ [42]. Высокая иммуногенность статинов приводит к развитию системных поражений, и у больных помимо легочных нарушений появляются признаки волчаночноподобного синдрома и псевдополимиозита [43].
Основным морфологическим субстратом бронхиолитов является продуктивное воспаление с повреждением эпителия, разрастанием в респираторных бронхиолах и альвеолах грануляционной ткани, формированием в альвеолах и бронхиолах фибротических масс – телец Массона [16, 39]. Клинически у таких больных обнаруживается смешанный тип дыхательных нарушений, в том числе с преобладанием рестрикции. В патогенезе ОБ важное значение отводят нарушениям межклеточных взаимодействий на территории как бронхиального дерева, так и легочного интерстиция. Установлена роль нейтрофилов как источников свободных радикалов, считающихся ведущими в развитии повреждения и бронхоконстрикции. Так как при ОБОП развивается бронхиальная обструкция, в схемах лечения обязательно необходимо использовать ингаляторные или системные стероиды, бронхолитики, муколитики, антиоксиданты.
Таблица 1. Препараты, вызывающие поражение органов дыхания
Антибиотики
Кардиотропные
Амфотерицин В
Амиодарон
Изониазид
Ингибиторы ангиотензинпревращающего фермента
Нитрофураны
Антикоагулянты
Стрептомицин
b-Блокаторы
Сульфасалазин
Гидралазин
Тетрациклин
Гидрохлортиазид
Этамбутол
Дипиридамол
Антикоагулянты, антиаритмики, антидепрессанты
Протамин
Карбамазепин
Токаинамид
Фенотиазид
Флекаинид
Хлордиазопероксид
Химиотерапевтические и иммуносупрессивные
Противовоспалительные
Блеомицин
Аспирин
Бусульфан
Метатрексат
Мелфалан
Пеницилламин
Тамоксифен
Соли золота
Хлорамбуцил
Цитостатики
Циклоспорин А
Азатиоприн
Этопозид
6-меркаптопурин
Прокарбазин
Гемцитабин
Наркотические
Метотрексат
Анксиолитики
Флюдарабин
Героин
Препараты, модифицирующие иммунный ответ
Кокаин
Гранулоцит-макрофагколониестимулирующий фактор
Метадон
Интерферон
Метилфенидат
Интерлейкин-2
Наркотические анальгетики
Фактор некроза опухолей
Седативные
Различные группы
b2-Агонисты (тербуталин, ритордин)
Бромкриптин
Дантролен
Ингибиторы аппетита
Метизергин
Минеральные масла
Токолитики
Триптофан
Таблица 2. Легочная гиперэозинофильная реакция
ЛС
Режим введения и сроки приема до развития побочных эффектов
Терапия
Изониазид
п/о
Отмена ЛС
Нитрофурантоин
п/о в течение часов, дней после начала приема
Положительная рентгенологическая динамика через 48 ч после отмены лекарственного средства
Парааминосалициловая кислота
п/о, спустя 3–4 нед после начала приема
Пенициллин
Парентерально, несколько часов, дней, через неделю после начала приема
При тяжелом течении –
Сульфаниламиды
п/о, местно, через 5–7 дней после начала приема
кортикостероиды в/в,
Тетрациклин
п/о, побочные эффекты встречаются редко
преднизолон до 300 мг
Азатиоприн
п/о, побочные эффекты через 1 год
ежедневно
Метатрексат
п/о, в/в, токсичность при приеме 20 мг в неделю
до купирования
Тяжелая токсичность при остром лимфоцитарном лейкозе
симптомов, затем внутрь
b-Адренергический
п/о, после месячного приема
в течение 10 дней
антагонист пропранолол
Редкие случаи
по 15 мг
Карбамазепин
п/о, после приема в течение 1–3 мес
Хлорпропамид
Кожная сыпь
Редкие случаи
Кромолин
Аэрозоль, дни или недели приема
Редкие сообщения; ассоциировано с наличием астмы
Дифенилгидантоин
п/о
Редкие случаи
Соли золота
Парентерально – месяцы приема, побочный эффект при накоплении 400–800 мг
Гидрохлортиазид
п/о
Редкие случаи
Имипрамин
п/о, дни – недели приема
Редкие случаи
НПВС (ибупрофен,
п/о, недели приема
индометацин, вольтарен)
Постепенное улучшение после отмены препарата
Примечание. п/о – пероральный прием, в/в –внутривенный прием.
Таблица 3. Бронхообструктивный синдром лекарственного генеза
ЛС
Механизм
Схемы терапии
Ацетилсалициловая кислота
п/о
Отмена лекарственного средства
НПВС
Бронхоспазм у 5–10% астматиков, даже если входит в состав пищевых продуктов
При тяжелом течении – кортикостероиды в/в, преднизолон до 300 мг ежедневно до
Химиотерапевтические средства
п/о, в/м
купирования симптомов, затем
(аспарагиназа, ципластин)
внутрь в течение 10 дней по 15 мг
Неселективные и селективные b-блокаторы
п/о, в/в; дозозависимость; пути введения; у пациентов
и антагонисты кальция
с обструктивной болезнью легких кардиоселективные
Холинергические агонисты (метахолин)
средства теряют избирательность с более высокой дозой
Нервно-мышечные блокаторы
в/в, в/м; дозозависимость
Искусственная вентиляция легких;
(d-тубокурарин, сукцинилхолин, атракуриум)
в/в кортикостероиды по 180 мг
в сутки до купирования симптомов
Препараты антихолинэстеразы (неостигмин)
п/о, в/м; дозозависимость; тяжесть реакции
Антагонисты антихолинэстеразы
обусловлена путями введения; у восприимчивых
(пралидоксим)
пациентов увеличивают холинергические влияния
Простагландин
Внутриматочный и в/в, в/м; бронхоспазм у астматиков
в/в кортикостероиды по 180 мг в сутки до купирования симптомов Бронхолитические средства(м-холинолитики, b2-агонисты через небулайзер)
D-пеницилламин
п/о; определенной зависимости от дозы нет;облитерирующий бронхиолит у редких пациентов с ревматоидным артритом
Пенициллин
Не зависит от пути введения, не зависит от дозы IgE-обусловленный бронхоспазм
Примечание. п/о – перорально; в/в – применяемый внутривенно; в/м – применяемый внутримышечно, НПВС – нестероидные противовоспалительные средства.
Таблица 4. Некардиогенный отек легких
ЛС
Механизм
Период до начала клинических проявлений
Терапия
Опиатные производные или
Передозировка в/в или п/о
До нескольких часов
Отмена препарата
аналоги (героин, морфий,
Высвобождение гистамина
Эвакуация желудочного
метадон, D-пропоксифен)
Повреждение эндотелия
содержимого O2
Ацетилсалициловая кислота
Передозировка случайная или
В течение часа
Искусственная вентиляция легких
умышленная, серологические
уровни >45 mg/dl
Дезинтоксикационные средства
Хлордиазопероксид
в/в или п/о передозировка таблеток
Симтоматическая терапия
Колхицин
Передозировка п/о (150 мг)
В течение 24 ч после
передозировки
Протамин
Дозозависимость не ясна в/в
До нескольких часов
Цитозин арабинозид
У пациентов с острым лейкозом;
До 30 дней от введения
не ясна дозозависимость
последней дозы
Токолитики
п/о или в/в дозозависимость
До 24 ч
Амфотерицин В (ассоциировано с переливанием лейкоцитной массы)
в/в не зависит от дозы
При нейтропении сразу или вскоре после переливаний лейкоцитной массы (amphotericin-индуцированный лизис перелитых клеток и вторичное повреждение легкого)
Примечание. п/о – перорально; в/в – внутривенно.
Таблица 5. Тромбоэмболия легочной артерии, легочная гипертензия
ЛС
Механизм, режим введения
Терапия
Оральные контрацептивы (эстрогены, прогестероны)
п/о, в/в, локальный дозозависимый
Отмена лекарственного средства Антикоагулянты
Внутривенная жирная эмульсия
Микротромбоэмболия, респираторный дистресс-синдром
Отмена средства
Нелекарственные средства: тальк, крахмал, сода, вата и т.д
в/в
ИВЛ, кортикостероиды в/в по 180 мг до купирования симптомов
Адренергические носовые распыления
Годы употребления
Отмена лекарственного средства
Гестагены, прогестин
в/в, п/о, местно; дозозависимость не изучена; побочные эффекты – через несколько недель
Протамин
в/в; дозозависимости нет
Дезинтоксикационная терапия
Примечание. п/о – перорально; в/в – применяемый внутривенно.
Таблица 6. Дифференциальный диагноз лекарственной и спонтанной СКВ
Клиника
СКВ
Лекарственная СКВ
Возраст
20–40
50
Женщины/мужчины
9:1
1:1
Раса
Любая
Не чернокожие
Тип ацетилирования
Быстрые и медленные
Быстрые
Артриты, %
90
95
Плевроперикардит, %
50
50
Гепатомегалия, %
25
25
Поражения кожи, %
74
10–20
Поражение почек, %
53
5
Поражение ЦНС, %
32
0
Антинуклеарный фактор, %
95
Редко
LE-клетки, %
90
Отсутствуют
Комплемент
Снижен
Норма
Иммунные комплексы
Повышены
Норма
Таблица 7. Интерстициальный пневмонит/фиброз
ЛС
Режим введения
Особенности течения
Терапия
Азатиоприн
п/о до 1,5–24 мес
Прекратить прием
Блеомицин
Парентерально
Увеличивается риск с возрастом,
Зависимость от дозы (450 мг)
хронической обструктивной болезнью
Бусульфан
п/о, доза >600 мг
легких, облучением легких, использованием
Хлорамбуцил
п/о >2 г
в протоколах комбинированной
Циклофосфамид
в/в, п/о, прием 40–250, месяцы, годы
химиотерапии, кислорода
Мелфалан
п/о, длительно, годы
Митомицин
в/в недели, месяцы, не зависит от дозы
Радиация
Зависимость от дозы и продолжительности
Ограниченный областью радиации
Искусственное дыхание
воздействия 4000 Gy
медленно прогрессирующий фиброз
Радиоактивный йод
Годы лечения
Адренергический назальный спрей
Годы злоупотребления
Прекратить прием Назначение кортикостероидов
Амиодарон
п/о, зависимость от дозы >400 мг/день
Возможно, вызывают легочную
в течение месяцев
и системную болезнь накопления
Карбамазепин
п/о, месяцы, годы употребления
липидов и вторичное воспаление
Кромолин
Аэрозоль, длительное употребление
Дифенил
п/о, месяцы, годы приема
D-пеницилламин
п/о, прием в течение 2–3 лет
Нитрофураны
п/о, зависимость от дозы в диапазоне
25–50 мг/день от 6 мес до 7 лет
Кислород
Несколько месяцев
Свободнорадикальное повреждение легких
Соблюдение режима вентиляции O2
Фенилбутазон
п/о
Пневмосклероз редко
Прекратить прием
Примечание. п/о – пероральный; в/в – внутривенно.
Некардиогенный отек легких
Некардиогенный отек легких проявляется острым респираторным дистресс-синдромом уже через несколько часов после введения препарата (табл. 4). В основе патогенеза болезни лежит повреждение легочного эндотелия с увеличением сосудистой проницаемости. Общими клиническими симптомами отека легких являются одышка, двусторонняя легочная инфильтрация, размеры сердца при этом не меняются. Высокий риск некардиогенного отека легких наблюдается при приеме героина, наркотических анальгетиков (морфина, меперидина, метадона) [43], вдыхании кокаина, местном применении анестетиков – орофарингеальных аппликациях лидокаина. Также отек легких развивается при приеме салицилатов. Вероятность его выше при хроническом их использовании, когда больные увеличивают дозу для купирования мышечно-суставного синдрома. К факторам риска относятся пожилой возраст, длительный анамнез курения. Интоксикация салицилатами сопровождается потерей сознания, метаболическими нарушениями, лихорадкой. Известно, что отек легких возможен при передозировке аспирина. Тяжесть побочных эффектов не зависит от концентрации препарата в крови [44].
При лечении цитостатиками отек легких, по некоторым данным, возникает у 20% больных. Введение блеомицина, циклофосфана, изофосфамида, метатрексата интратрахеально приводит к развитию лекарственных осложнений в течение 1 мес лечения.
Среди более редких причин отека легких известны диуретики. В патогенезе побочных эффектов терапии диуретиками участвуют реакции гиперчувствительности. Заболевание проявляется остро, уже через 20–60 мин при системном введении. Появляются кашель, одышка, боли в грудной клетке, повышение или падение уровня артериального давления (АД), в легких выслушиваюся мелкопузырчатые хрипы, цианоз, реже – лихорадка. Прогноз при отеке легких, вызванном диуретиками, благоприятный, заболевание достаточно быстро купируется при отмене препарата.
При приеме токолитиков частота отека легких невелика. Факторами риска являются:
• перегрузка парентеральным введением растворов,
• многоплодная беременность,
• анемия, лечение стероидами с целью ускорения созревания плода и нестабильная гемодинамика у матери.
Данные обстоятельства снижают периферическое сосудистое сопротивление, что приводит к задержке жидкости в периферическом сосудистом русле легких.
Тактика ведения больных с некардиогенным отеком легких основана на принципах ведения неотложных состояний (см. табл. 4).
Легочные лекарственные васкулопатии
Выделяют 3 типа легочных сосудистых нарушений, вызванных лекарствами: легочная гипертензия, тромбоэмболическая болезнь, легочное кровотечение.
Легочная гипертензия определяется как повышение среднего давления в легочной артерии на 5–10 мм рт. ст. выше нормальных показателей (9–18 мм рт. ст.). С середины 50-х годов 20-го столетия в Европе наблюдается рост заболеваемости легочной гипертензией, что было связано с бесконтрольным приемом препаратов, угнетающих аппетит, злоупотреблением наркотиками [42]. Типичными морфологическими проявлениями при лекарственной легочной гипертензии являются плексиформные сосудистые сплетения, расположенные на плевре и легких и образованные расширенными ветвями сосудов с тонкими стенками, состоящими из одиночной эластической мембраны. Клиническая картина представлена головокружениями с обмороками, сердцебиениями, кашлем и кровохарканьем. Заболевание протекает тяжело, прогноз неблагоприятный.
Тромбоэмболическая болезнь (тромбоэмболия легочной артерии) возникает при использовании оральных контрацептивов (табл. 5) вследствие эстрогензависимого влияния на печеночный метаболизм факторов свертывания. Показано, что тромбоэмболические осложнения чаще развиваются при приеме оральных контрацептивов III поколения, содержащих в составе прогестина дезогестрел или гестоген. Предрасположенность к тромбозам сосудов легких у женщин, принимающих контрацептивы, в том числе и с заместительной целью, возрастает в течение первых лет приема, в климактерический период, при ожирении, курении, венозной болезни нижних конечностей, при наследственной предрасположенности к тромбофилии.
Легочный эмболический синдром также встречается у больных героиновой наркоманией из-за инородных тел, содержащихся в разбавителях наркотика или для его фильтрования перед внутривенным введением (тальк, лактоза, сода, крахмал и т.п.). Облитерация легочного сосуда происходит как за счет эмболии инородными телами, так и в результате гранулематозной реакции на инородное тело [16].
Другой источник индуцированных эмболических явлений – введение маслосодержащих средств, контрастов для лимфангиографии. Это приводит к широко распространенным окклюзиям легочных капилляров каплями липида от 24 до 48 ч после введения [8]. Подобная реакция иногда следует за использованием жирных эмульсий, применяемых внутривенно для парентерального питания и в неонаталогии.
Из неинвазивных и вместе с тем высокоинформативных способов исследования при подозрении на тромбоэмболию легочной артерии рекомендуется проведение спиральной компьютерной томографии легких, ультразвукового исследования вен нижних конечностей с компрессией. У больных с риском тромбоэмболических осложнений, в особенности в условиях ятрогенного риска, необходимы мониторирование состояния легочной перфузии, контроль коагулограммы с определением в плазме концентрации Д-димера.
Легочное кровотечение может быть осложнением системной антикоагулянтной терапии, обычно при передозировке всех типов антикоагулянтов, в том числе и низкомолекулярных гепаринов. Частыми осложнениями такого лечения являются острая легочная эмболия и образование инфаркта. Реже легочное кровотечение встречается в результате терапии другими лекарственными средствами: нитрофуранами, D-пеницилламинами. Легочное кровотечение при лечении цитостатиками связано с развитием лекарственно-обусловленного легочно-почечного синдрома по типу синдрома Гудпасчера.
Лекарственно-индуцированная системная красная волчанка
Среди причин волчаночноподобного синдрома известно большое количество препаратов. Патогенез лекарственной системной красной волчанки (СКВ) до настоящего времени изучен недостаточно. Клиническо-лабораторный синдром, вызванный этими средствами, имеет сходство с СКВ – артралгии, миалгии, полисерозит, кожные изменения, анемия, ускоренная СОЭ, поражение почек. Легкие при лекарственной СКВ занимают позиции органа-мишени. Поражение органов дыхания диагностируется у 50–75% больных с лекарственной СКВ и вносит основной вклад в клиническую тяжесть болезни.
Клиническая картина
Лекарственное поражение легких представлено плевральным выпотом без плевральных болей, множественной инфильтрацией, пневмонитом. В отличие от спонтанной волчанки лекарственная СКВ развивается с одинаковой частотой у женщин и мужчин (табл. 6). Лекарственная СКВ отличается от спонтанной формы заболевания отсутствием типичных для LE-клеток. Поражения кожи в виде дискоидной эритемы, неврологическая симптоматика, почечная патология при лекарственной волчанке встречаются редко.
Приблизительно у 50% пациентов, употребляющих прокаинамид, в течение 2 мес могут появиться антиядерные антитела. Больные жалуются на плевральную боль, у 10% развиваются плевральные выпоты, рентгенологически – симптом "матового стекла", интерстициальный фиброз. Прекращение использования прокаинамида обычно сопровождается исчезновением симптомов в течение нескольких недель. В редких случаях активность заболевания сохраняется в течение длительного времени после прекращения приема препарата.
Лекарственный синдром волчанки при приеме гидралазина встречается после длительной терапии относительно высокими суточными дозами, т.е. более 3 мес, со средней суточной дозой от 300 до 400 мг в день. Хотя приблизительно у 50% обнаруживаются положительные антиядерные антитела, развернутая картина СКВ регистрируется не более чем в 5%. В целом элементы гидралазин-индуцированного легочного синдрома отмечаются приблизительно у 25% больных. Отличительная особенность гидралазин-индуцированной волчанки – то, что проявления могут сохраниться в течение месяцев или лет после прекращения использования ЛС.
Интерстициальный пневмонит (фиброзирующий альвеолит)
Интерстициальное поражение легких по типу фиброзирующего альвеолита, в особенности при остром начале, напоминает некардиогенный отек легких. Хроническое течение сходно с идиопатическим фиброзирующим альвеолитом. Наблюдаются прогрессирующий кашель, одышка, рентгенологически – типичная для интерстициальной болезни легких картина усиления и деформации легочного рисунка с участками "матового стекла". Прогноз в большинстве случаев неблагоприятный и сопровождается некардиогенным отеком легких. Классическим примером интерстициального легочного фиброза лекарственного генеза является пневмонит, вызванный блеомицином. Помимо того, многие цитостатики, нитрофураны, амиодарон вызывают интерстициальный фиброз (табл. 7).
Интерстициальный пневмонит – общая модель повреждения, с которым сталкиваются при развитии лекарственной легочной болезни. ЛС или их метаболиты повреждают эндотелий, эпителиальные структуры, легочный интерстиций. Цитотоксические реакции индуцируют воспаление, что характеризуется накоплением макрофагов, лимфоцитов и других иммунокомпетентных клеток, в том числе с фиброгенной активностью. В результате в легких накапливаются патологические типы коллагена, развиваются склероз и ремоделирование легочной ткани.
Морфологически при лекарственной интерстициальной болезни легких изменения подобны различным формам идиопатических интерстициальных пневмоний и могут содержать элементы обычной интерстициальной пневмонии, в том числе и "сотового легкого". Так как иммуновоспалительные реакции не прекращаются и после отмены препарата, то заболевание характеризуется прогрессирующим течением. В таких случаях даже прекращение приема ЛС не позволяет купировать клиническую активность болезни.
Плевральный выпот
Ведущими причинами плеврального выпота являются злокачественные новообразования, туберкулез, пневмония и эмболия ветвей легочной артерии. На долю плевральных выпотов, вызванных лекарствами, приходится лишь небольшая часть заболеваний плевры. После прекращения приема препарата наблюдается рассасывание выпота, что служит важным дифференциально-диагностическом признаком лекарственной болезни, особенно когда причину плевральной реакции установить не удается.
Плевральный выпот формируется при приеме следующих препаратов:
Фурадонин
Дантролен
Метизергин
Бромкриптин
Прокарбазин
Метатрексат
Практолол
Нитрофураны до настоящего времени широко используются в лечении инфекции мочевыводящих путей. Механизмы побочных эффектов недостаточно изучены. Как при волчаночном синдроме, предполагают аутоиммунные нарушения, аллергические процессы. Большинство авторов, описывающих лекарственную болезнь, вызванную нитрофуранами, свидетельствуют об остром течении заболевания с ознобом, лихорадкой, кашлем и одышкой. Особенностью лекарственного поражения, вызванного нитрофуранами, является латентный период в течение 2–3 нед между началом приема препаратов и развернутой картиной болезни. Рентгенологически у больных обнаруживается инфильтрация в легких, и у трети больных плевральный выпот сопровождается очаговыми изменениями в легких. Иногда плевральный выпот образуется и при отсутствии инфильтрации. В острый период заболевания отмечается эозинофилия, лимфопения. В плевральной жидкости также отмечается эозинофилия (до 17%). Выпот чаще бывает транссудатом, но при некоторых формах плевральной реакции (например, воздействие датролена) – экссудатом с невысокой активностью амилазы. При отмене препарата в течение недели наблюдается улучшение состояния, исчезновение выпота.
В.С. Коровкин
Лекарственные поражения лёгких
Белорусская медицинская академия последипломного образования
Интерес к проблеме лекарственных поражений в целом, и легких в частности, обусловлен возможностью выявления четкого этиологического фактора с перспективой его устранения и предотвращения прогрессирования болезни. Однако диагностировать заболевание легких, индуцированное лекарствами, не всегда просто из-за отсутствия специфических клинических и морфологических проявлений.
Частота разнообразных побочных эффектов лекарственной терапии увеличивается, что обусловлено стремительным развитием фармакологии и появлением в клинической практике все новых препаратов. Побочного действия лекарств можно представить в виде следующей весьма упрощенной классификации.
Таблица 1 КЛАССИФИКАЦИЯ ПОБОЧНОГО ДЕЙСТВИЯ ЛЕКАРСТВ
Фармакологическое
Токсическое
при передозировке
при нарушении экскреторной функции органов
при кумуляции
Иммунные нарушения (лекарственная болезнь)
Псевдоаллергические реакции (идиосинкразия)
По данным Бостонской объединенной программы наблюдения за лекарствами (1984), большинство лекарств в 1—3% случаев вызывают аллергические реакции, примерно у 5% взрослого населения имелись аллергические реакции на одно и более лекарств, частота смертельных исходов вследствие таких аллергических реакций составляет 1:10000. Факторы риска развития побочных эффектов лекарств представлены в табл. 2.
Таблица 2 ФАКТОРЫ РИСКА РАЗВИТИЯ ПОБОЧНЫХЭФФЕКТОВ ЛЕКАРСТВ
Пожилой возраст
Женский пол
Профессия (медицинские работники)
Особенности фонового заболевания
Нарушение функции печени и/или почек
Аллергические реакции в анамнезе
Радиация
Особенности гормональных и метаболических реакций
Лекарственная полипрогмазия
Беспорядочное назначение лекарств
Лекарственная болезнь — это неспецифическая иммунологическая (аллергическая) реакция организма на применение терапевтических или разрешающих доз медикаментов, проявляющаяся разнообразными клиническими синдромами. В 50-е годы Е.М. Тареев выделил ятрогенный тип болезни, которую впоследствии стали называть лекарственной.
Лекарственная болезнь может быть представлена неспецифическими синдромами (кожным, суставным, гематологическим, лихорадкой, бронхиальной астмой, анафилактическим шоком, синдромом сывороточной болезни) или органными поражениями (нефрит, гепатит, фиброзирующий альвеолит, миокардит). Особое место занимает «большая лекарственная болезнь», протекающая по типу системной красной волчанки, узелкового периартериита, пурпуры Шенлейна—Геноха, тромботической тромбоцитопенической пурпуры и др. Риск смертельного исхода при лекарственной болезни наиболее высок в случае анафилактического шока, острого токсико-аллергического дерматита (синдром Лайелла), стекловидного отека гортани.
100 лет назад Е.А.Аркиным был предложен термин «лекарственная болезнь» для обозначения кожных сыпей, вызываемых лекарственными препаратами. В 1957 г. Е.М. Тареев ввел этот термин в клиническую практику, сравнив лекарственную болезнь с сывороточной болезнью. С осложнениями лекарственной терапии современный врач сталкивается все чаще. Каковы клинические варианты лекарственных поражений легких?
Первый случай лекарственного поражения легких описал У. Ослер, наблюдавший некардиогенный отек легких, вызванный злоупотреблением морфином. Попытку систематизации таких поражений сделал E. Rosenhow(1972), включив в классификацию поражения средостения и плевры, нарушения иннервации дыхательной мускулатуры, повреждение легочных сосудов, патологические реакции бронхиального дерева, лекарственный волчаночный синдром, поражения легочного интерстиция. В развитии лекарственных поражений легких большую роль играют предрасполагающие факторы: наследственность, особенности конституции, сопутствующие заболевания, вредные привычки, сочетание различных методов лечения и диагностики.
Большинство реакций развиваются по механизму гиперчувствительности (экссудативный плеврит, лимфаденопатия, бронхоспазм, аллергический альвеолит, васкулит) и могут сопровождаться поражением кожи, суставов, почек, лихорадкой, эозинофилией крови. Реже встречаются иммуновоспалительные реакции, обусловленные межклеточными взаимодействиями и характеризующиеся чередованием фаз затихания и обострения. В 1982 г. A.Reynoldsобъединил такие реакции в группу «иммунных болезней легких».
Наиболее частыми вариантами лекарственных поражений легких являются бронхиальная астма, легочная гиперэозинофилия, аллергический и фиброзирующий альвеолиты, гранулематозный васкулит. Поражения средостения включают лимфаденопатию (псевдолимфоматозная трансформация при использовании дифенилгидантоина или реакция гиперчувствительности при назначении метотрексата) и липоматоз медиастинальной клетчатки в рамках лекарственного синдрома Иценко—Кушинга. Нарушения иннервации легких развиваются на двух уровнях — центральном (блокада дыхательного центра при применении наркотических, седативных средств и транквилизаторов) и периферическом (блокада нервно-мышечных синапсов, которую вызывают аминогликозиды и некоторые полимиксины, курареподобные средства).
Поражение плевры чаще сочетается с изменениями в паренхиме легких — серозит при реакциях гиперчувствительности, волчаночном синдроме, фиброз плевры развивается при проведении лучевой терапии или лечении пропранололом. Алкалоиды спорыньи (метисергид, эрготамин) вызывают не только склероз плевры, но и ретроперитонеальный фиброз и фиброзное утолщение створок клапанов сердца. Препараты различных групп могут быть причиной повреждения сосудов легких с развитием респираторного дистресс-синдрома, реже тромбоэмболии, тромбозов, легочной гипертонии. Легочный васкулит встречается при лечении нитрофуранами, сульфа-ниламидами, пенициллином, гидралазином и прокаинамидом. Для него характерно наличие системных проявлений — поражения кожи, суставов, мышц и т.д. При длительном применении D-пеницилламина описано развитие синдрома Гудпасчера,
Лекарственные поражения дыхательных путей могут протекать в виде бронхоспазма и бронхиолита. Бронхоспазм чаще относится к дозонезависимым реакциям. При непереносимости нестероидных противовоспалительных средств развивается так называемая «аспириновая» астма. Некоторые препараты (рентгеноконтрастные средства, тартразин, пенициллины и др.) вызывают анафилактические реакции, связанные с образованием IgE. При использовании бета-адреноблокаторов, холинергических и антихолинэстеразных средств наблюдаются дозозависимые бронхоспастические реакции. Облитерирующий бронхиолит встречается при лечении D-пеницилламином.
Лекарственный пневмонит может наблюдаться как самостоятельно, так и в рамках волчаночного синдрома, который вызывают гидралазин, изониазид, дифенилгидантоин, антибиотики и сульфаниламиды. Патологический процесс локализуется в альвеолярном эпителии и базальной мембране эндотелия сосудов, реже поражаются респираторные бронхиолы. Лекарственный волчаночный синдром склонен к рецидивам. Проявления лекарственного пневмонита неспецифичны: одышка, интерстициальные изменения на рентгенограммах грудной клетки, нарушения функции внешнего дыхания.
В 1985 г. G. Akounпредложил критерии диагностики лекарственного пневмонита: 1) прием лекарственных средств, которые могут вызывать поражение интерстициальной ткани легких; 2) уменьшение изменений при отмене препаратов; 3) хроническое рецидивирующее течение в отличие от синдрома гиперчувствительности; 4) данные цитограммы бронхоальвеолярного смыва, которые позволяют уточнить тип поражения. Например, нейтрофильный характер цитограммы может свидетельствовать о преобладании процесса фиброза. Однако даже использование предложенных критериев не всегда позволяет подтвердить лекарственную природу поражения легких. Однотипные изменения цитограммы бронхоальвеолярного смыва и морфологические изменения встречаются при идиопатическом фиброзирующем альвеолите, фиброзирующем альвеолите в рамках диффузных заболеваний соединительной ткани, экзогенном аллергическом альвеолите.
В Международной классификации болезней 10 пересмотра (1992) в рубрике J18 «Пневмония без уточненного возбудителя» исключены лекарственные интерстициальные болезни легкого (J70.2-J70.4), но числится «пневмонит, вызванный внешними агентами (J67-70)».
Поражение легких при применении лекарственных веществ может быть обусловлено нецитотоксическими и цитотоксическими реакциями. В первом случае развивается аллергический альвеолит, или гиперчувствительный пневмонит, во втором — токсический (фиброзирующий) альвеолит. Такое деление условно, так как аллергические реакции также могут приводить к развитию хронического иммунного воспаления и фиброзу интерстициальной ткани легких. Гиперчувствительный пневмонит встречается при использовании антибиотиков, сульфаниламидов, препаратов золота и характеризуется лимфоцитарно-эозинофильной инфильтрацией интерстициальной ткани, иногда с образованием гранулем, дистрофическими изменениями клеток эпителия альвеол. Изменения носят подострый характер и чаще обратимы.
Фиброзирующий альвеолит, как правило, встречается при использовании цитотоксических препаратов (блеомицин, метотрексат, азатиоприн и др.); патогенетически он не отличается от идиопатического фиброзирующего альвеолита. Для диагностики, помимо рентгенографии, имеют значение изменения клеточного состава бронхоальвеолярного смыва (нейтрофильный альвеолит) и морфологическая картина. Заболевание может начаться остро и медленно прогрессирует. Лечение включает длительное применение глюкокортикоидов (иногда пульс – терапией), реже цитостатиков.
Частое и широкое использование амиодарона в клинической практике выявило его побочные эффекты, одним из которых является «амиодароновое легкое».
Амиодарон (кордарон) используется в клинической практике более 35 лет. Это препарат из группы бензофурина, обладающий антиодренергической активностью, увеличивающей энергетические резервы сердечной мышцы, и уменьшающий потребление миокарда кислородом, т.е. сочетающий в себе свойства коронародилататора, антагониста альфа и бета-адренорецепторов и антиаритмического средства. Препарат широко применяется для профилактики и лечения желудочковой и наджелудочковой аритмии. Удобство его приема (1 раз в сутки) обусловлено большим периодом полувыведения (24 дня).
Однако длительное лечение амиодароном сопровождается рядом осложнений: кератопатией, фототоксическими, реже аллергическими кожными реакциями, поражением щитовидной железы, пневмопатией.
Первое описание токсической пневмопатии, обусловленной приемом амиодарона, принадлежит H. Rotmenschи соавт. (1980). Они наблюдали 50-летнего пациента, у которого развился симптомокомплекс в виде прогрессирующей одышки, выраженной гипоксемии, рентгенологической картины многофокусной инфильтрации легочной ткани и рестриктивных вентиляционных нарушений. На сегодняшний день накоплен значительный опыт диагностики и лечения этой своеобразной формы лекарственного поражения легких.
Поражение легких при использовании амиодарона имеет несколько названий: «амиодароновое» легкое, «кордароновая» пневмопатия, фосфолипидоз легких, Последнее название патогенетически оправдано, поскольку механизм поражения легких обусловлен способностью метаболитов амиодарона связывать липиды лизосом альвеолярных макрофагов, вызывать нарушение катаболизма фосфолипидов, которые откладываются в виде пластинчатых телец в альвеолах, приводя к замедлению диффузии газов через альвеолярную мембрану Исследования последних лет доказывают возможность развития фиброза при «амиодароновом» легком. При проведении бронхоальвеолярного лаважа можно обнаружить характерные «пенистые» макрофаги, появляющиеся в ответ на фосфолипидную активность кордарона. Имеются сообщения о том, что подобные изменения выявляются в лимфатических узлах, печени, селезенке, иногда в нейтрофилах периферической крови,
В настоящее время выделяют два ведущих варианта течения «амиодаронового» легкого. В 70% имеет место подострое или хроническое развитие симптомов с появлением непродуктивного кашля, похудания, редко бывает лихорадка. При рентгенографии органов грудной клетки определяется двусторонняя мелкоочаговая диссеминация.
Второй вариант характеризуется более острым началом с лихорадкой и симптомами интоксикации. Рентгенологически определяются очагово-сливные затемнения легочной ткани, как правило, по периферии легких. Именно данному варианту соответствует течение болезни у нашего пациента.
Клинические симптомы обычно возникают через 1—2 мес. после начала терапии амиодароном.. Предположительно о «амиодароновой» пневмопатии можно высказаться при наличии двух и более признаков, представленных в табл. 3.
Таблица 3 КЛИНИЧЕСКИЕ ПРИЗНАКИ «АМИОДАРОНОВОГО» ЛЕГКОГО (R.DUSMANИ СОАВТ., 1990)
· Появление отсутствовавших до этого одышки, непродуктивного кашля, плевральных болей и др,
· Появление диффузных интерстициальных и/или паренхиматозных изменений в легких при рентгенографии органов грудной клетки
· Снижение диффузионной способности легких для СО на 20% и более по сравнению с исходным уровнем
· Патологическое включение в ткань легких радиоизотопа «Go
· Морфологические изменения, обнаруживаемые при гистологическом изучении биоптатов легочной ткани в виде «неспецифического» альвеолита
· Обратное развитие клинико-рентгенологических проявлений поражения легких после отмены (уменьшения дозы) амиодарона и назначения глюкокортикостероидов
· Исключение застойной сердечной недостаточности с развитием интерстициального отека легких, поражения легких при диффузных заболеваниях соединительной ткани, инфекционных заболеваниях, метастатического поражения, тромбоэмболии мелких ветвей легочной артерии.
При развитии «амиодаронового» легкого необходимо отменить препарат. Поражение легких исчезает через 1—2 мес. При выраженном поражении легочной ткани назначают глю-кокортикостероиды, Для профилактики побочных эффектов кордарона его сочетают с небольшими дозами глюкокортикостероидов.
Наряду с «амиодароновым» легким, поражение щитовидной железы является серьезным и прогностически значимым побочным эффектом данного препарата. Амиодарон вызывает преходящее уменьшение синтеза и секреции тиреоидных гормонов, тормозит превращение тироксина в трийодтиронин в периферических тканях, повышает резистентность клеток-мишеней периферических тканей к действию тиреоидных гормонов. Длительное применение поддерживающих доз амиодарона может приводить к нарушению функции щитовидной железы (гипо- и гипертиреоз).
Одна таблетка кордарона (200 мг) содержит 75 мг неорганического йода, что почти в 100 раз превышает суточную потребность в этом элементе. Однако в большинстве случаев амиодарон вызывает изменения в гипоталамо-гипофизарно-тиреоидной системе без клинических признаков нарушения функции щитовидной железы. Описано появление у некоторых больных под влиянием кордарона антитиреоидных антител (к тиреоглобулину, к микросомальной фракции). При назначении амиодарона и в процессе длительного лечения этим препаратом необходимо оценивать исходный уровень гормонов щитовидной железы (ТЗ, Т4) и тиреотропного гормона, а также аутоантител.
Итак, мы рассмотрели механизмы развития и клинические варианты лекарственных поражений легких, в частности «амиодаронового» легкого. Знание побочных эффектов терапии амиодароном позволит врачам предотвратить возможность их развития.
Лекарственно-индуцированные заболевания
http://www.learningradiology.com/lectures/chestlectures/Drug-Induced%20Pulmonary%20Disease-2012/Drug-Induced%20Pulmonary%20Disease-2012.html
Продолжение.
Продолжение.
Раздел ЭАА с артефактами и не встречается в других темах, предлагаю вынести его в отдельную тему, т.к. границы его шире лекарственно-индуцированных изменений в легких.