Пол пациента:
Тип патологии:
Область исследования:
Методы исследования:
- https://radiomed.ru/sites/default/files/styles/case_slider_image/public/user/12/2.p3220007a.jpg?itok=6Czcrqzo
- https://radiomed.ru/sites/default/files/styles/case_slider_image/public/user/12/3.p3220008.jpg?itok=AjZm2Pde
- https://radiomed.ru/sites/default/files/styles/case_slider_image/public/user/12/4.p3220008a.jpg?itok=2530BwlP
- https://radiomed.ru/sites/default/files/styles/case_slider_image/public/user/12/5.p3220009.jpg?itok=YyXmKUsi
- https://radiomed.ru/sites/default/files/styles/case_slider_image/public/user/12/6.p3220009a.jpg?itok=BmH0oo3F
- https://radiomed.ru/sites/default/files/styles/case_slider_image/public/user/12/7.p3220010.jpg?itok=3ZKRFNcd
- https://radiomed.ru/sites/default/files/styles/case_slider_image/public/user/12/8.p3220010a.jpg?itok=yY92ojIk
ID:20879

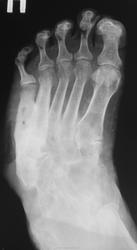
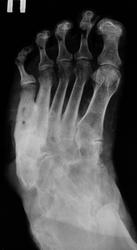
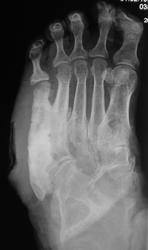
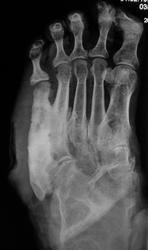
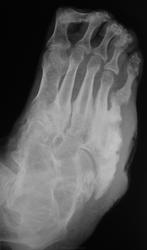
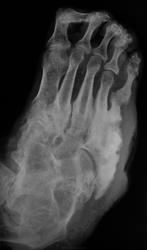
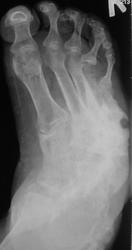
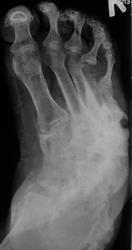
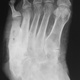

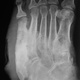





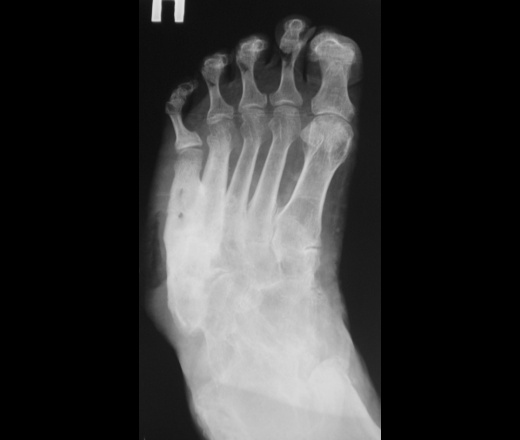
интересная статья по теме в ассистенте http://www.radiologyassistant.nl/en/4b6e855359a09 фрагмент, перевод браузерный
раскаленной ноги у пациентов с диабетической нейропатии является диагностической проблемой.
В этом обзоре мы остановимся на двух вопросах:
Обзор
Остеомиелит против Шарко
Остеомиелит
Остеомиелит в диабетической нейропатии с инфекцией костей, который обычно является результатом непрерывного распространения язва кожи.
Таким образом, наиболее распространенным местом для остеомиелит не в средней части стопы, но в акупунктурных точках стопы (плюсневой головки, IP суставов), а в задней части стопы на подошвенной стороне задней пяточной кости.
Для определения того, остеомиелит присутствует, это поместить маркер на пути язвы или пазухи и отслеживать его до кости и оценить МР-сигнал интенсивности костного мозга (1).
Активное Шарко
в отличие от остеомиелита, Шарко нейро-остеоартропатии в первую очередь суставов заболевание, которое чаще всего расположены всредней части стопы .
В начале рентгенография этапе не будет демонстрировать кости аномалии, но МРТ покажет субхондральный отек костного мозга.
подкожного мягких тканей, не активное участие.
Да статья интересная, я уже скопировал её для набора.
Внешний вид.
Остеоартропатия Шарко.
Ромейко Дмитрий Иосифович, кандидат медицинских наук, зав. кабинета «Диабетическая стопа» Городского эндокринологического диспансера
Шепелькевич Алла Петровна, кандидат медицинских наук, ассистент 1-й кафедры внутренних болезней, БГМУ
Остеоартропатия Шарко (ОШ) привлекает внимание ученых всего мира уже около 130 лет. Являясь квинтэссенцией синдрома диабетической стопы (СДС), ОШ приводит к анатомическому разрушению костно-связочного аппарата стопы и является основой развития гнойно-некротического процесса тканей стоп, приводя к потере (полной или частичной) функциональных способностей нижних конечностей, тяжелой инвалидизации, стойкой потере трудоспособности, а порой и смерти больных (после ампутаций выше коленного сустава).
Приоритет в изучении вопроса принадлежит французским, немецким, американским и английским исследователям. В зарубежной литературе общепринят термин «нейроартропатия Шарко» ("Charcot neuroarthropathy"), чем подчеркивается этиологическая связь с неврологическим дефицитом [1]. В русскоязычной литературе встречается несколько терминов: «диабетическая остеоартропатия» (ДОАП), «остеоартропатия Шарко», а также стопа или сустав Шарко [2].
Определение, эпидемиология
ОШ сегодня определяется как прогрессирующее заболевание костей и суставов, характеризующееся болевой или безболевой деструкцией костей и суставов конечностей, происходящей на фоне потери сенсорной иннервации [3]. В международном соглашении по диабетической стопе 1999 года ОШ определена как неинфекционная деструкция костей и суставов стоп, ассоциированная с диабетической нейропатией [4].
По данным западноевропейских и американских исследователей, частота встречаемости ОШ среди больных СД около 1 % [2,3], при нейропатической форме СДС и (или) у больных с периферической нейропатией - 29 % [3].
Этиопатогенез
В возникновении и развитии ОШ играют роль многие факторы: периферическая соматическая и автономная нейропатия, остеопения и остеопороз, механическая травма, аномалии мягких тканей стоп (рис 1):
Рис. 1. Патогенез остеоартропатии Шарко.
Представленный комплекс метаболических, нейрососудистых нарушений, дисфункция костно-связочного аппарата стопы, является основой для возникновения и развития ОШ.
Рис. 2. Анатомическая классификация остеоартропатии Шарко (Levin, 1999)
Классификация
Выделяют анатомическую классификацию ОШ (Sanders & Frykberg, 1991), включающую 5 различных классов, в зависимости от вовлеченного в патологический процесс сустава [2] (рис. 2).
Первых два класса клинико-анатомически склонны к язвообразованию на подошвенной части стопы. Наиболее часто встречаются первые три анатомических класса, именно они и приводят к значительным структурным деформациям и функциональной нестабильности суставов.
Постадийные клинико-рентгенологические изменения делятся (по Eichenholtz, 1996) на 3 стадии [2] (табл. 2).
Таблица 2 Клинико-рентгенологические стадии развития ДОАП (по Eichenholtz, 1996)
Клинические признаки ОШ
Манифестация проявляется, как правило, безболезненными ощущениями пациента при функциональной нагрузке на конечность (чувство «хруста» в стопе, «провала» во время ходьбы), реже - умеренной болезненностью и отечностью стопы. Сенсорная функция может находиться на различной стадии расстройства (вплоть до полного отсутствия). Может иметь место травма в анамнезе.
Клиническая картина ОШ (после манифестации) включает 4 фазы развития [1].
Острая фаза: ее длительность, в среднем, составляет 3-4 недели, характеризуется отеком стопы, умеренной гиперемией тканей и локальной гипертермией кожи пораженной стопы (в месте произошедшего перелома костей) (рис. 3).
Рис. 3. Острая фаза нейроартропатии Шарко (международный консенсус по диабетической стопе, 1999).
Боль и лихорадка не характерны, может иметь место субфибрилитет. Рентгенологические изменения, как правило, отсутствуют, обнаруживается остеопения и остеопороз костей стоп.
Подострая фаза: длится от 3-4 недель до 3-4 месяцев (редко более), характеризуется костной фрагментацией и началом деформации костей. Происходит изменение архитектоники и структуры стопы, в зависимости от вовлеченных в патологический процесс костно-суставных структур (рис. 4).
Рис. 4. Подострая фаза нейроартропатии Шарко (больная К., 36 лет, спустя 4 мес. после напряженного перелома костей стоп).
Воспалительная реакция и отечный синдром в этой фазе, как правило, имеют тенденцию к снижению. Эта фаза уже рентгенпозитивная - определяются костно-суставные фрагментации (рис. 5).
Рис. 5. Рентгенологическая картина подострой фазы ОШ (международный консенсус по диабетической стопе, 1999).
Хроническая фаза: развивается обычно, после 4-6 месяцев. Наблюдаются выраженные деформации стопы, с изменением ее размеров и объема, наличие спонтанных переломов и вывихов. Вид деформации зависит от локализации поражения. В типичных случаях (анатомический класс II - III) остеодеформации развиваются по типу «пресс-папье» или «стопы-качалки» (рис. 6), что сопровождается вальгусной деформацией внутреннего края стопы в области предплюсны, крючкообразной деформацией пальцев.
Рис. 6. Хроническая фаза ОШ (больная Л., 54 года, в центре область формирования язвенного дефекта на фоне выраженного гиперкератоза).
Рентгенологически определяется фрагментация костных структур, выраженная деформация скелета стопы, периостальные и параоссальные обызвествления. Как правило, имеет место полное нарушение функциональных способностей конечности, внешне (по клинико-рентгенологическим характеристикам) стопа в этой фазе описывается, как «мешок с костями».
Фаза осложнений: хроническая осложненная фаза развивается в условиях отсутствия должной лечебно-профилактической помощи (включая, прежде всего, ортопедическое пособие) больным в 1-3 фазу процесса. На стопе развивается язвенный дефект возникает на участках стопы, испытывающих наибольшее давление, особенно на плантарной поверхности и в межпальцевых промежутках [13].
Прогноз ДОАП в значительной степени определяется как локализацией и объемом деструкции костно-суставных структур в острой фазе процесса, так и продолжающейся статико-динамической нагрузкой (особенно в сочетании с отсутствием должного ортопедического пособия) в фазах развития.
Диагностика
Диагноз ОШ устанавливается на основании:
1. клинической картины (особенно на ранних стадиях развития);
2. и методов определения состояния костных структур:
- оценки минеральной плотности костной ткани,
- рентгенологического анализа,
- магнитно-резонансной томографии (МРТ),
- сцинтиграфии,
- определения биохимических параметров костного метаболизма,
- гистологического исследования патологически измененной костной ткани.
Определенный диагностический вес имеют и рутинные методы общеклинического лабораторного исследования (общий анализ крови (лейкоциты и СОЭ), биохимический анализ крови (кислая и щелочная фосфатаза), диагностика нарушения кроватока и состояния центральной и периферической иннервации).
Инструментальные методы.
Рентгенография - один из самых доступных методов рутинной диагностики костной патологии. Остеоартропатический сустав на рентгенограмме выглядит как тяжелая форма дегенеративного или атрофического артрита [26]. В русскоязычной литературе эти изменения описаны А.А. Перелыгиной и соавторами в 1986г., которые выделяют четыре группы поражений:
1. атрофические процессы (субартикулярные единичные или множественные поражения, спонтанные переломы и деформации; деструктивные остеомиелитические поражения в виде исчезновения участка кости - "симптом тающего сахара"; локальный и распространенный остеопороз);
2. гипертрофические процессы (субхондральный остеосклероз и экзостозы, особенно пяточной и ладьевидной костей, утолщение хряща, образование краевых остеофитов, часто деструкция головки 1-й плюсневой кости с формированием плоско-вальгусной деформации стоп);
3. суставные поражения (сужение или полное отсутствие суставной щели, подвывихи и вывихи в суставах, часто в плюсне-сесамовидном сочленении, остеопороз суставных поверхностей);
4. поражения мягких тканей (обызвествления сосудов, отек и утолщение мягких тканей, скопление газа).
Острая стадия ОШ характеризуется деминерализацией и остеолизом. В активной фазе выявляется дезинтеграция сустава, подвывихи, остеопения, патологические переломы, отек мягких тканей, расценивающиеся, как атрофические изменения. Для хронической стадии наиболее характерны гипертрофические процессы. В поздней репаративной стадии ОШ выявляется пролиферация новообразованной кости, как результат нейропатических переломов, анкилоз вовлеченных суставов и частичное их восстановление.
В англоязычной литературе рентгенологические признаки при ОШ описаны, как симптомы пяти «Д» (joint distension, dislocation, debris, disorganisation, increased density) [2].
Следует, однако отметить, что метод рентгенографии выявляет изменения костной ткани на поздних стадиях развития процесса и не позволяет дифференцировать ОШ от другой патологии костной ткани, наблюдающейся у больных СД.
Магнитно-резонансная томография (МРТ) позволяет четко дифференцировать воспалительные заболевания костной ткани (остеомиелит) от ОШ (понижение игнала от кости, несмотря на сохраненную пульсовую последовательность) [26]. МРТ позволяет более точно описать границы инфекционного процеса, что важно для определения объема оперативного вмешательства.
Диагностическая чувствительность, специфичность и точность различных инструментальных методов исследования представлены в табл. 3 [2].
Таблица 3 Диагнотическая чувствительность, специфичность и точность некоторых методов исследования костной ткани (А.М. Мкртрумян, Э.Р. Хасанова, 1990)
Количественные методы
Денситометрия. Ключевым звеном в инстументальной диагностике ОШ является выяление локального и системного снижения костной массы [5]. Общепризнанным золотым стандартом в ранней диагностике остеопороза, на сегодняшнтй день, является ДРА, позволяющая определять до 1-6% потери костной массы. Минеральная плотность костной ткани (МПКТ) является одним из важнейших факторов, определяющих прочность костной ткани и, соответственно, ее подверженность переломам [5,6,11,12].
На основе МПКТ вычисляются показатели Z и T, являющиеся частью стандартного квадратичного отклонения, что позволяет учитывать вариабельность показателя МПКТ в популяции. Группой экспертов ВОЗ по остеопорозу были предложены диагностические критерии степени выраженности деминерализации костной ткани [6] на основе измерения МПКТ (табл. 4).
Таблица 4 Стадии остеопороза по данным денситометрии (европейские стандарты)
Лабораторная диагностика. В рутинной практике исследуются показатели, отражающие наличие воспалительного процесса: повышение уровня лейкоцитов, СОЭ, С-реактивный белок.
Потребность в доступных неинвазивных методах обосновывает поиски новых маркеров костной ткани. В исследовательской практике определяют следующие показатели костного метаболизма, отвечающие на изменения в структуре кости значительно быстрее, чем инструментальные методы [6]:
1. маркеры костной резорбции: экскреция кальция / креатинина с мочой, оксипролин, татрарезистентная кислая фосфатаза,экскреция с мочой пиридинолина (ПИР) и дезоксипиридинолина (Д-ПИР);
2. маркеры остеосинтеза: общая и костно-специфическая щелочная фосфатаза, костный gla-протеин плазмы (Pbgp, или остеокальцин, N-концевой (аминотерминальный) и C-концевой (карбокситерминальный) пропептиды проколлагена I-го типа.
Гистологическое и гистоморфологическое исследование. Эти методы используются для определения количественных и качественных характеристик костной ткани, что позволяет увеличить знания о патогенетических механизмах изменения прочности костной ткани. Только 50% переломов обусловлены диабетической остеопенией, остальные 50% обусловлены изменением качественных характеристик костной ткани [2]. Имеются предположения, что больные СД 1 типа подвержены остеопорозу больше, чем больные СД 2 типа (из-за различий в патогенезе диабетической остеопении), что подтверждает гипотезу о различном патогенезе хронических осложнений у больных СД 1 и СД 2 типов. При СД 1 типа определяющий тип резорбции - остеопластическая резорбция по лакунарному типу, а при СД 2 типа - периостеоцитарный остеолизис и гладкая резорбция. [3].
Рис. 8. А) Типичная трофическая язва при нейропатической форме СДС (ОШ слева, больной К., 64 года); Б) Трофические язвы обеих стоп, развившиеся в области проекции головок плюсневых костей (больной У., 33 года).
Диабетическая остеоартропатия (ОАП, стопа Шарко, сустав Шарко) — редкое, но крайне тяжелое осложнение сахарного диабета, при неадекватном лечении приводящее к необратимой инвалидизации. Это осложнение можно назвать одной из самых загадочных форм синдрома диабетической стопы, так как предсказать развитие ОАП и выделить группы риска среди пациентов С сахарным диабетом крайне трудно. С этим осложнением диабета встречаются врачи разных специальностей: хирурги, эндокринологи, ортопеды, но далеко не всегда оно вовремя распознается.
Современное определение диабетической остеоартропатии — «деструкция кости и сустава неинфекционного характера, вызванная диабетической нейропатией».
Деструктивная остеоартропатия была описана в XIX веке французским неврологом Шарко, но не при сахарном диабете (в доинсулиновую эру поздние осложнения диабета практически не встречались), а при сифилитическом поражении проводящих путей спинного мозга (tabesdorsalis). Впоследствии было установлено, что подобные изменения суставов стоп также встречаются при различных заболеваниях, приводящих к нарушению иннервации нижних конечностей (сирингомиелии, диабетической полинейропатии и др.). В настоящее время наиболее частой формой остеоартропатии является диабетическая.
Распространенность данного осложнения среди больных сахарным диабетом составляет менее 1%, хотя в литературе встречаются данные о поражении костной ткани стоп у 0,1-55% больных. Такая противоречивость сведений,очевидно,связана с различиями в методике обследования и разными критериями диагностики остеоартропатии.
Локализация поражений
В подавляющем большинстве случаев ОАП поражает кости и суставы стоп. В 1991 году была предложена классификация ОАП в зависимости от локализации процесса. У 20-25% пациентов ОАП поражает обе стопы, но обычно не одновременно. Встречаются случаи ОАП с поражением других суставов: коленного и даже локтевого.
Этиология, патогенез и естественное течение ОАП
Остеоартропатия — это по сути поражение костной ткани в отличие от типичных форм остеопороза, имеющих исключительно локальный характер. Причиной такого поражения кости является нарушение иннервации нижних конечностей вследствие диабетической нейропатии.
Длительное время развитие ОАП рассматривалось в основном с позиций нейротравматической и нейро-васкулярной. Согласно первой, моторная и сенсорная (посредством утраты проприоцептивных рефлексов) формы нейропатии приводят к нарушениям биомеханики стопы. Результатом этого является аномальная нагрузка на отдельные суставы стопы при ходьбе, приводящая через некоторое время к их деструкции. Альтернативная теория основана на обнаружении при ОАП признаков артсриовенозного шунтирования крови через сосудистое русло костной ткани, в связи с чем было сделано заключение о ведущей роли аномального усиления кровотока в костной ткани в развитии локальной остеопении. В 1989 году ученые выдвинули предположение о том, что в развитии ОАП определенную роль играют как рецидивирующая травма стоп, так и усиление кровотока в костной ткани. Таким образом оба этих патологических процесса нашли отражение в «синтетической» теории.
Известно, что ОАП не развивается у пациентов с нарушениями кровоснабжения нижних конечностей. Это объясняется тем, что при ишемической и нейроишемической формах синдрома диабетической стопы невозможно аномальное усиление кровотока в костной ткани.
Несмотря на то что факт развития ОАП лишь при тяжелой диабетической нейропатии хорошо известен, предсказать развитие ОАП практически невозможно, так как это осложнение возникает далеко не у всех больных даже с выраженной нейропатией. В связи с этим было высказано предположение, что ОАП вызывает не любая форма, а лишь определенные «подвиды» нейропатии. В 1992 году британские исследователи выдвинули гипотезу (впоследствии подтвержденную в ряде работ), что к ОАП приводит особая форма диабетической нейропатии с преимущественным поражением миелиновых нервных волокон и относительной сохранностью безмиелиновых, что вызывает нарушение тонуса микрососудов, которое влечет за собой усиление кровотока в костной ткани.
Эти патологические процессы служат предпосылкой, своего рода фоном для манифестации ОАП — остеопороза дистальных отделов нижних конечностей, снижающего устойчивость кости к повреждающим воздействиям. В этой ситуации провоцирующий фактор (минимальная травма при ходьбе или хирургическое вмешательство на стопе) приводит к повреждению кости или усилению в ней кровотока, активации остеокластов и «запускает» бурный и безостановочный процесс остеолиза, в отсутствие лечения приводящий к разрушению скелета стопы.
После манифестации ОАП процесс проходит четыре стадии.
Первая (острая) стадия характеризуется отеком стопы, умеренной гиперемией и местной гипертермией. Боли и лихорадка нехарактерны. Рентгенография может не выявлять деструктивных изменений (на этой стадии они представлены лишь микропереломами); обнаруживается остеопороз костей стоп.
Вторая (подострая): фрагментация костей и начало деформации стопы. В типичных случаях происходит уплощение свода стопы на пораженной стороне. Отек и воспалительные явления в этой стадии уменьшаются. Рентгенологически определяются фрагментации костных структур.
Третья (хроническая): выраженная деформация стопы, наличие спонтанных переломов и вывихов. Вид деформации зависит от локализации поражения. В типичных случаях нагрузки на стопу при ходьбе приводят к деформации по типу «пресс-папье» или «стопы-качалки». Это сопровождается вальгусной деформацией внутреннего края стопы в области предплюсны, клювовидной деформацией пальцев. Рентгенологически — фрагментация костей, выраженная деформация скелета, периостальное и параоссалыюе обызвествление. Функция скелета стопы полностью нарушается, в тяжелых случаях стопу можно образно сравнить с «мешком с костями».
Четвертая (стадия осложнений): перегрузка отдельных участков деформированной стопы приводит к образованию язвенных дефектов; при их инфицировании возможно развитие флегмоны стопы, остеомиелита, гангрены.
Диагностика
Из-за сложности лечения ОАП, а также в связи с тем, что в популяции это состояние встречается достаточно редко, пациентов с подозрением на ОАП для диагностики и лечения следует направлять в специализированные отделения (центры) «Диабетическая стопа».ОАП диагностируется на основании клинической картины, анамнеза (небольшая травма, хирургическое вмешательство) и рентгенологических признаков, соответствующих той или иной стадии. Очень часто из-за недостаточной информированности врачей общей практики об ОАП это осложнение ошибочно диагностируется как лимфостаз, тромбофлебит, флегмона стопы и др. Наиболее затруднен дифференциальный диагноз в острой стадии, когда несвоевременное начало адекватного лечения приводит к необратимой инвалидизации.
Дифференциальная диагностика ОАП в острой фазе включает два основных вопроса:
- Являются ли воспалительные изменения следствием поражения костных структур или их следует рассматривать как проявление другого заболевания (флегмоны стопы, острого тромбофлебита, подагрического артрита, ревматических поражений суставов и др.)?
- При наличии рентгенографических признаков деструкции кости имеет она неинфекционную (ОАП) или инфекционную (остеомиелит) природу?
Для решения первого вопроса необходимы данные рентгенографии стоп (хотя в острой фазе могут присутствовать лишь неспецифические изменения в виде остеопороза). Магнитно-резонансная томография и сцинтиграфия скелета стопы выявляют микропереломы, воспалительные изменения, усиление кровотока в пораженных костях.
Возможна оценка биохимических маркеров распада костной ткани (гидроксипролина, дезоксипиридинолина, фрагментов коллагена и др.). С аналогичной целью могут использоваться и маркеры перестройки костной ткани, отражающие активность остеобластов (то есть остеосинтеза), — костный изофермент щелочной фосфатазы и др. Но уровень этих веществ во многом зависит от активности процессов распада костной ткани в скелете в целом.
Очевидно, что изменения, характерные для других заболеваний: признаки острого тромбофлебита при УЗДГ венозной системы, типичная клиника подагрического артрита (с болевым синдромом и лихорадкой, соответствующей рентгенологической и биохимической картиной) и прочие — делают диагноз ОАП менее вероятным. Для остальных случаев наиболее приемлемым на сегодняшний день алгоритмом диагностики ОАП в острой фазе можно считать следующий.
При возникновении у больного сахарным диабетом одностороннего отека стопы (особенно при неповрежденной коже) следует обязательно исключить возможность ОАП. При подозрении на ОАП и при повышенном риске ее развития (длительное течение сахарного диабета, выраженная диабетическая нейропатия) целесообразнее назначить лечение сразу, чем через несколько месяцев наблюдать необратимую деформацию стопы.
Второй вопрос чаще возникает при наличии трофической язвы стопы или в послеоперационном периоде после ампутации в пределах стопы или другого оперативного вмешательства. Это связано с тем, что остеомиелит при синдроме диабетической стопы чаще всего вторичный, являющийся осложнением трофической язвы или раневого процесса. В решении этого вопроса помогают данные анализа крови: нейтрофильный лейкоцитоз характерен (хотя и необязателен) для остеомиелита, но не для ОАП. Об остеомиелите свидетельствуют также некоторые рентгенологические признаки (реакция надкостницы), а также наличие свища, зондирование костных структур в дне раны. Эффективный, но малодоступный метод исследования – сцинтиграфия скелета с введением лейкоцитов с радиоактивной меткой. «Золотым стандартом» в определении природы деструкции костной ткани является биопсия кости.