Синдром диабетической стопы в клинической практике
Оболенский В.Н., Семенова Т.В., Леваль П.Ш., Плотников А.А., г. Москва, Россия
Определение
На симпозиуме ВОЗ «Сахарный диабет» (Женева, 1987) синдром диабетической стопы (СДС) был определен как патологическое состояние стопы при сахарном диабете (СД), возникающее на фоне патологии периферических нервов и сосудов, характеризующееся поражением кожи и мягких тканей, костей и суставов, проявляющееся в виде трофических язв, костносуставных изменений и гнойнонекротических процессов [1].
В Международном соглашении по диабетической стопе (2000) было принято определение СДС как комплекса анатомофункциональных изменений стопы у больного СД, связанного с диабетической нейропатией, ангиопатией, остеоартропатией, на фоне которых развиваются гнойнонекротические процессы [2].
Подход к лечению больных с СДС должен быть мультидисциплинарным и объединять специалистов различных профилей: эндокринолог (диабетолог), хирург (сосудистая и гнойная хирургия), ортопед (подиатр), психолог, терапевт, анестезиологреаниматолог, а также подготовленный средний медицинский персонал.
Классификация
С 1991 г. ВОЗ было принято выделение нейропатической (без остеоартропатии и с остеоартропатией), ишемической и нейроишемической форм СДС [1].
В последнее время, по данным ряда авторов, ишемическую форму как отдельную не выделяют, относя ее к нейроишемической, мотивируя тем, что у больных СД в той или иной степени присутствует поражение периферической нервной системы [3–5]. Кроме того, как отдельную выделяют нейроостеоартропатическую форму [5].
наиболее широко используется классификация F.W. Wagner (1979) (табл. 1) [6] по степени выраженности поражения тканей стопы при СДС.
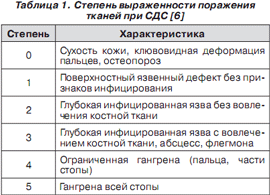
Многие авторы считают недостатком классификации Вагнера отсутствие в ней учета различных вариантов сочетания факторов глубины поражения тканей, наличия инфекции и ишемии.
Предпочтительнее выглядит классификация Техасского университета, которая впервые была опубликована L.A. Lavaery, D.G. Armstrong, L.B. Harkless в журнале Foot Ankle Surg., 1996, № 35, с. 528531 (табл. 2 и 3) [7, 8]. Классификация состоит из двух частей:
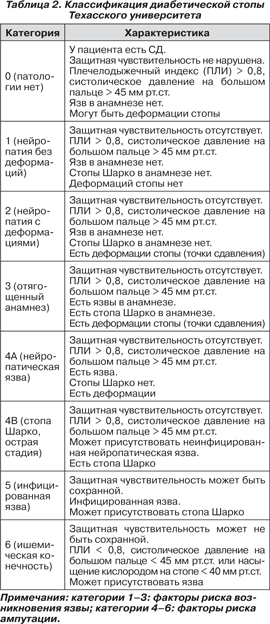

— классификация диабетической стопы, которая оценивает риск возникновения язвы и риск ампутации;
— классификация диабетических язв, которая учитывает степень (по вертикали) и стадию (по горизонтали) язвенного дефекта.
Степень 0 — отсутствие язвенного дефекта, I — поверхностное поражение мягких тканей, II — язва, распространяющаяся до сухожилия или суставной сумки, III — язва, распространяющаяся до кости или сустава; стадия A — поражение без инфекции и ишемии, B — поражение с инфекцией, C — с ишемией, D — с инфекцией и с ишемией. Риск ампутации при I степени возрастает по стадиям A < C < B < D, при II–III степени A < В < С < D. Прогноз первичной эпителизации язвы ухудшается по стадиям A > C > B > D [8].
В 2000 г. W.J. Jeffcoat, R.M. Macfarlane, K. Treece (Великобритания) предложили новую систему классификации диабетических язв S(AD)SAD, основанную на пяти основных клинических признаках: объем — size (область и глубина), сепсис (sepsis), артериопатия и денервация, где каждый из признаков градируется от 0 до 3 с применением количественных и качественных критериев [7]. Однако S(AD)SAD не получила пока широкого распространения.

Классификация PEDIS язвенных дефектов у больных с СДС представлена в табл. 4 [9].
Классификациядиабетическойостеоартропатии:
Стадия 1 — наличие отека стопы, гипертермия и гиперемия.
Стадия 2 — формирование деформации стопы; рентгенологически определяются костные изменения в виде остеопороза, костной деструкции, фрагментации костных структур.
Стадия 3 — выраженная деформация стопы, спонтанные переломы и вывихи.
Стадия 4 — образование язвенных дефектов, при инфицировании возможно быстрое развитие гангрены.
Для удобства клиницистов в 2004 г. было предложено ведение медицинской документации пациентов с хроническими раневыми дефектами по системе MEASURE, включающей в себя ключевые параметры, используемые при оценке и лечении таких ран: М (Measure) — измерение раны (длина, ширина, глубина и площадь), Е (Exudate) — экссудат (количество и качество), A (Appearance) — внешний вид (раневое ложе, тип ткани и количество), S (Suffering) — болевой синдром (характер и интенсивность боли), U (Undermining) — деструкция (наличие или отсутствие), R (Reevaluate) — наблюдение (регулярный контроль всех параметров), Е (Edge) — край (состояние краев раны и окружающей кожи) [11, 12]. Данная система предназначена для стандартизации терминологии и определения последовательности подходов к клинической оценке раны.
Факторы риска развития СДС
Ведущие факторы риска диабетической язвы стоп: нейропатия, поражение периферических сосудов (периферический атеросклероз сосудов нижних конечностей — склероз Менкеберга), деформация стоп c формированием зон высокого давления; предшествующие язвы, длительный стаж диабета, курение, высокий уровень гликозилированного гемоглобина, недостаток обучения, снижение остроты зрения, неадекватная обувь, пожилой возраст [10].
Факторы риска развития СДС, по мнению ведущих специалистов [13], в настоящее время выглядят следующим образом:
— периферическая сенсомоторная и автономная нейропатия;
— хроническая артериальная недостаточность нижних конечностей;
— деформации стоп;
— предшествующие язвы и/или ампутации;
— травма;
— неправильно подобранная обувь;
— социальнопсихологические факторы;
— расовая принадлежность.
Факторы, предрасполагающие к язвообразованию у больных диабетом, можно представить следующим образом:
а) факторы, снижающие сопротивляемость тканей травме:
— патология крупных сосудов: атеросклероз, мужской пол, курение;
— патология мелких сосудов;
— автономная нейропатия;
б) факторы, увеличивающие вероятность травмы:
— моторная нейропатия;
— сенсорная нейропатия;
— ограничение подвижности суставов;
— другие осложнения диабета, включая нарушение остроты зрения;
— осложнения, связанные с возрастом: шаткость походки, малоподвижность.
Эпидемиология
По данным Международной диабетической федерации, в настоящее время в мире насчитывается 4,9 млн больных СД 1го типа и ожидается увеличение до 5,3 млн к 2011 г., в то время как количество больных СД 2го типа в мире 151 млн, а к 2011 г. ожидается 213 млн [14].
Развитие гнойнонекротических процессов на фоне СДС в 50–75 % случаев приводит к ампутации. Частота ампутаций у больных СД, по данным различных источников, в 17–45 раз выше, чем у лиц, не страдающих СД; до 30 % пациентов после первой ампутации подвергаются ампутации второй конечности в течение ближайших 3 лет, и до 50 % — в течение 5 лет.
Патогенез
В качестве факторов патогенеза развития диабетической нейропатии рассматривают хроническую недостаточность инсулина и гипергликемию (частота нейропатии при 1м и 2м типах СД одинакова); накопление сорбитола (сорбитол, накапливаясь в шванновских клетках периферических нервов, вызывает их дегенерацию, сегментарную демиелинизацию, аксонопатию); неферментное гликирование белков (приводящее к структурным и химическим изменениям в нерве и нарушающее его нормальную функцию); снижение активности антиоксидантов (глутатиона, супероксиддисмутазы, витаминов Е и С), приводящее к повышению уровня свободных радикалов; недостаток витаминов группы В, являющихся активными участниками цикла Кребса (нарушение метаболизма глюкозы в нервной ткани, увеличение уровня свободных радикалов и продуктов перекисного окисления липидов); снижение миоинозитола — субстрата синтеза фосфатидилинозитола — эндогенного регулятора почечной микросомальной NaKaАТФазы (в норме в периферическом нерве поддерживается 90– 100кратный градиент концентрации миоинозитола, а у пациентов с СД градиент концентрации миоинозитола снижается почти в 2 раза). Микроангиопатия сосудов, в том числе vasa nervorum, является основной причиной нейропатии у пациентов с СД — отмечается характерное утолщение эндотелия эндоневральных сосудов, более выраженное, чем в капиллярах кожи, мышц, в эпи и периневральных сосудах.
Диабетическая нейропатия (ДН) — это симптомокомплекс, вызванный дегенерацией периферических и автономных нервов у больных СД [13]. При тщательном обследовании больных СД нейропатия выявляется в 100 % случаев. Два механизма лежат в основе развития ДН — метаболические и сосудистые нарушения.
Диабетическую нейропатию подразделяют на автономную, сенсорную (острую и хроническую) и моторную; по морфологическому типу ввыделяют аксональный тип, демиелинизированный тип, смешанный тип.
Раневой процесс при демиелинизированном типе протекает с непрерывным формированием вторичных некрозов, осложняется контактным остеомиелитом костей стопы; при смешанном типе течение раневого процесса несколько благоприятнее, при аксональном типе переход раневого процесса из I во II фазу происходит почти в 2 раза быстрее, однако регенерация протекает значительно медленнее.
Автономная (вегетативная) нейропатия (вегетативный дисбаланс, аутосимпатэктомия) — облигатное осложнение СД, влияет на возникновение и прогрессирование СДС; она приводит к нарушению регуляции микроциркуляторной вазодилатации, распределения кровотока и его ауторегуляции. Возрастает кровоток через артериовенозные шунты в коже и костной ткани, что приводит к усилению резорбции кости и развитию остеоартропатии; происходит обызвествление медии артерий, чаще на голени и стопе (склероз Менкенберга), нарастают нейропатические отеки, уменьшается потоотделение, что приводит к сухости кожи, образованию гиперкератоза, трещин и мозолей.
Острая сенсорная нейропатия наиболее часто встречается после метаболических нарушений, сопровождающихся кетоацидозом; появляются внезапные парестезии и гиперстезии, потеря тактильной чувствительности. Хроническая сенсорная нейропатия характеризуется нарушением всех видов чувствительности: температурной, болевой, вибрационной. При потере чувствительности наиболее высок риск безболезненной травмы (механической, термической, химической).
Моторная нейропатия способствует развитию паралича мышц стопы, что приводит к деформации стопы и нарушению походки. Вследствие этого возникают зоны повышенного давления (например, в области плюснефаланговых суставов), что способствует формированию мозолей и язв в этой области.
Диабетическая остеоартропатия, развивающаяся вследствие дегенеративных изменений костных структур и связочного аппарата, приводит к развитию остеопороза, остеолиза, гиперостоза, формированию деформаций стопы (в т.ч. молоткообразных пальцев, Hallus valgus, сустава или стопы Шарко), появлению зон повышенного плантарного давления, что также способствует образованию язв.
Диабетическая ангиопатия делится на макроангиопатию (артерии) и микроангиопатию (капилляры и артериолы). Макроангиопатия обусловлена атеросклерозом, кальцифицирующим склерозом Менкенберга и диффузным фиброзом интимы. Антитромбогенная активность эндотелия стенки сосуда достоверно ниже при наличии диабетической нейропатии. Снижение перфузионного давления в микрососудистом русле на фоне поражения как магистральных артерий, так и капилляров приводит к развитию комплекса патологических изменений и в итоге к некротическим изменениям мягких тканей.
Пусковым механизмом развития осложненных форм СДС чаще всего является микротравма — случайные повреждения при ходьбе босиком, неправильно подобранная обувь или индивидуальные особенности ходьбы, приводящие к потертостям или сдавлениям, повреждения мягких тканей при обработке ногтей, незамеченные ожоги (чаще от бытовых приборов и батарей).
Диабетические язвы стоп характеризуются хроническим течением в связи с рядом проблем, нарушающих процесс заживления. Вопервых, вызванная автономной нейропатией микроциркуляторная дисфункция сопровождается перераспределением кровотока с преобладанием артериовенозного сброса и обеднением нутритивного капиллярного звена кожи. Внутрикапиллярная гипертензия вызывает развитие тканевого отека, увеличение межкапиллярного расстояния и развитие гипоксии тканей. Сенсорная нейропатия способствует нарушению всех защитных сенсорных реакций, в том числе и снижению степени ухода за раной со стороны самого больного. Вовторых, нарушенное заживление ран при диабете связано с комплексом нарушений местных воспалительных и иммунных реакций: снижением образования тромбоцитами ростовых факторов, развитием изменений внеклеточного матрикса, снижением функции капилляров и нейтрофильных лейкоцитов. Значительное влияние на скорость заживления оказывает местная оксигенация кожи — результат влияния ишемии и инфекции, основных прогностических факторов исхода лечения. Дополнительным фактором, оказывающим принципиальное влияние на скорость заживления и частоту рецидивов, является механический стресс в условиях снижения чувствительности и перераспределения давления на стопе. Таким образом, заживление диабетических поражений стоп происходит в крайне «неблагоприятных» условиях, и поэтому ведение диабетических ран на стопе должно максимально приближать условия заживления к физиологическим [17].
Возникновение и развитие гнойнонекротических форм СДС схематично можно представить так: факторы риска — образование язв, ишемия — гангрена — ампутация.
Диагностика
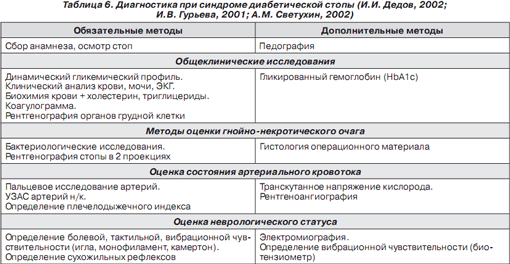
Диагностика при СДС включает в себя сбор анамнеза (длительность СД, длительность гипергликемии, характер лекарственной терапии, наличие в анамнезе язв на стопах и хирургических вмешательств, сердечнососудистых заболеваний, артериальной гипертензии, дислипидемии, нефропатии и ретинопатии, условия жизни, злоупотребление алкоголем и курением, характер обуви), осмотр стоп, оценку неврологического статуса, состояния артериального кровотока и опорнодвигательного аппарата, лабораторную и инструментальную диагностику, измерение распределения плантарного давления.
Лабораторная диагностика — определение уровня гликемии, уровня гликированного гемоглобина (HbA1c), наличия глюкозы и кетоновых тел в моче, уровня холестерина, триглицеридов, фибриногена, АЧТВ и ТВ, оценка состояния системы ПОЛ — АОЗ. При наличии раневого дефекта — бактериологические исследования, гистологические исследования операционного материала.
Диагностика нейропатии — оценка жалоб по шкалам TSS и NSS (показатели нейропатического симптоматического счета), исследование болевой, тактильной, вибрационной и температурной чувствительности (укол тупой иглой на тыльной поверхности большого пальца стопы, монофиламент 10 г, градуированный камертон, биотензиометрия), их оценка по шкале NDS (показатели нейропатического дисфункционального счета), оценка сухожильных рефлексов, электромиография. Исследование вегетативного дисбаланса — холтеровское мониторирование ритма сердца и суточный мониторинг АД.
Оценка кровотока и микроциркуляции — пальцевое исследование артерий, определение плечелодыжечного индекса (ПЛИ), ультразвуковая допплерография и сегментарная допплероманометрия, ультразвуковое ангиосканирование (УЗАС), транскутанная оксиметрия (ТсрО2), лазерная допплеровская флоуметрия, полярография, компьютерная капилляроскопия, рентгеноконтрастная ангиография, магнитнорезонансная ангиография, мультиспиральная компьютерная томографияангиография, измерение пальцевого систолического давления, стресстесты (тредмилтест), изучение эндотелийзависимой вазодилатации (веноокклюзионная плетизмография на фоне введения ацетилхолина и нитроглицерина), реолимфовазография, импедансометрия, тепловизионное исследование.
Диагностика остеоартропатии — рентгенография стопы в двух проекциях, рентгенологическая и ультразвуковая денситометрия. Дифференциальная диагностика остеоартропатии и остеомиелита — биохимические маркеры костного метаболизма (остеокальцин, костный изофермент ЩФ).
При наличии раневого дефекта обязательными являются микробиологические исследования, которые должны производиться повторно в процессе лечения (коррекция эмпирической антибактериальной терапии, высокая вероятность реинфицирования открытых послеоперационных ран, в т.ч. резистентными госпитальными штаммами микроорганизмов). При нейропатической форме СДС преобладает грамположительная флора (до 70 % — Staphylococcus aureus), при наличии ишемии — грамотрицательная флора (чаще всего — Pseudomonas aeruginosa), при нейроишемической форме — смешанная флора, ассоциации микроорганизмов.
У больных СД часто (до 60 %) выявляется микотическое поражение стоп (онихомикоз, микоз стоп). Выделение грибковой флоры из ран при СДС — до 80 % случаев (дерматофиты, дрожжевые и плесневые грибы) (табл. 5).

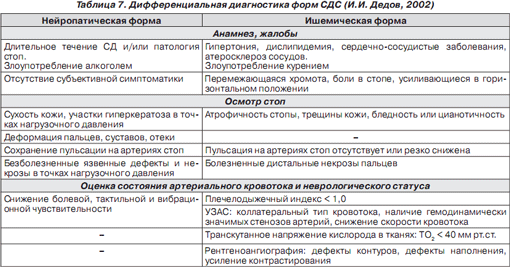
Диагностика и дифференциальная диагностика при СДС представлена в табл. 6 и 7.
Диабетическая остеоартропатия (ОАП, стопа Шарко, сустав Шарко) - редкое, но крайне тяжелое осложнение сахарного диабета, при неадекватном лечении приводящее к необратимой инвалидизации. Это осложнение можно назвать одной из самых загадочных форм синдрома диабетической стопы, так как предсказать развитие ОАП и выделить группы риска среди пациентов С сахарным диабетом крайне трудно. С этим осложнением диабета встречаются врачи разных специальностей: хирурги, эндокринологи, ортопеды, но далеко не всегда оно вовремя распознается.
Современное определение диабетической остеоартропатии - «деструкция кости и сустава неинфекционного характера, вызванная диабетической нейропатией».
Деструктивная остеоартропатия была описана в XIX веке французским неврологом Шарко, но не при сахарном диабете (в доинсулиновую эру поздние осложнения диабета практически не встречались), а при сифилитическом поражении проводящих путей спинного мозга (tabesdorsalis). Впоследствии было установлено, что подобные изменения суставов стоп также встречаются при различных заболеваниях, приводящих к нарушению иннервации нижних конечностей (сирингомиелии, диабетической полинейропатии и др.). В настоящее время наиболее частой формой остеоартропатии является диабетическая.
Распространенность данного осложнения среди больных сахарным диабетом составляет менее 1%, хотя в литературе встречаются данные о поражении костной ткани стоп у 0,1-55% больных. Такая противоречивость сведений,очевидно,связана с различиями в методике обследования и разными критериями диагностики остеоартропатии.
Локализация поражений
В подавляющем большинстве случаев ОАП поражает кости и суставы стоп. В 1991 году была предложена классификация ОАП в зависимости от локализации процесса. У 20-25% пациентов ОАП поражает обе стопы, но обычно не одновременно. Встречаются случаи ОАП с поражением других суставов: коленного и даже локтевого.
Этиология, патогенез и естественное течение ОАП
Остеоартропатия - это по сути поражение костной ткани в отличие от типичных форм остеопороза, имеющих исключительно локальный характер. Причиной такого поражения кости является нарушение иннервации нижних конечностей вследствие диабетической нейропатии.
Длительное время развитие ОАП рассматривалось в основном с позиций нейротравматической и нейро-васкулярной. Согласно первой, моторная и сенсорная (посредством утраты проприоцептивных рефлексов) формы нейропатии приводят к нарушениям биомеханики стопы. Результатом этого является аномальная нагрузка на отдельные суставы стопы при ходьбе, приводящая через некоторое время к их деструкции. Альтернативная теория основана на обнаружении при ОАП признаков артсриовенозного шунтирования крови через сосудистое русло костной ткани, в связи с чем было сделано заключение о ведущей роли аномального усиления кровотока в костной ткани в развитии локальной остеопении. В 1989 году ученые выдвинули предположение о том, что в развитии ОАП определенную роль играют как рецидивирующая травма стоп, так и усиление кровотока в костной ткани. Таким образом оба этих патологических процесса нашли отражение в «синтетической» теории.
Известно, что ОАП не развивается у пациентов с нарушениями кровоснабжения нижних конечностей. Это объясняется тем, что при ишемической и нейроишемической формах синдрома диабетической стопы невозможно аномальное усиление кровотока в костной ткани.
Несмотря на то что факт развития ОАП лишь при тяжелой диабетической нейропатии хорошо известен, предсказать развитие ОАП практически невозможно, так как это осложнение возникает далеко не у всех больных даже с выраженной нейропатией. В связи с этим было высказано предположение, что ОАП вызывает не любая форма, а лишь определенные «подвиды» нейропатии. В 1992 году британские исследователи выдвинули гипотезу (впоследствии подтвержденную в ряде работ), что к ОАП приводит особая форма диабетической нейропатии с преимущественным поражением миелиновых нервных волокон и относительной сохранностью безмиелиновых, что вызывает нарушение тонуса микрососудов, которое влечет за собой усиление кровотока в костной ткани.
Эти патологические процессы служат предпосылкой, своего рода фоном для манифестации ОАП - остеопороза дистальных отделов нижних конечностей, снижающего устойчивость кости к повреждающим воздействиям. В этой ситуации провоцирующий фактор (минимальная травма при ходьбе или хирургическое вмешательство на стопе) приводит к повреждению кости или усилению в ней кровотока, активации остеокластов и «запускает» бурный и безостановочный процесс остеолиза, в отсутствие лечения приводящий к разрушению скелета стопы.
После манифестации ОАП процесс проходит четыре стадии.
Первая (острая) стадия характеризуется отеком стопы, умеренной гиперемией и местной гипертермией. Боли и лихорадка нехарактерны. Рентгенография может не выявлять деструктивных изменений (на этой стадии они представлены лишь микропереломами); обнаруживается остеопороз костей стоп.
Вторая (подострая): фрагментация костей и начало деформации стопы. В типичных случаях происходит уплощение свода стопы на пораженной стороне. Отек и воспалительные явления в этой стадии уменьшаются. Рентгенологически определяются фрагментации костных структур.
Третья (хроническая): выраженная деформация стопы, наличие спонтанных переломов и вывихов. Вид деформации зависит от локализации поражения. В типичных случаях нагрузки на стопу при ходьбе приводят к деформации по типу «пресс-папье» или «стопы-качалки». Это сопровождается вальгусной деформацией внутреннего края стопы в области предплюсны, клювовидной деформацией пальцев. Рентгенологически - фрагментация костей, выраженная деформация скелета, периостальное и параоссалыюе обызвествление. Функция скелета стопы полностью нарушается, в тяжелых случаях стопу можно образно сравнить с «мешком с костями».
Четвертая (стадия осложнений): перегрузка отдельных участков деформированной стопы приводит к образованию язвенных дефектов; при их инфицировании возможно развитие флегмоны стопы, остеомиелита, гангрены.
Диагностика
Из-за сложности лечения ОАП, а также в связи с тем, что в популяции это состояние встречается достаточно редко, пациентов с подозрением на ОАП для диагностики и лечения следует направлять в специализированные отделения (центры) «Диабетическая стопа».ОАП диагностируется на основании клинической картины, анамнеза (небольшая травма, хирургическое вмешательство) и рентгенологических признаков, соответствующих той или иной стадии. Очень часто из-за недостаточной информированности врачей общей практики об ОАП это осложнение ошибочно диагностируется как лимфостаз, тромбофлебит, флегмона стопы и др. Наиболее затруднен дифференциальный диагноз в острой стадии, когда несвоевременное начало адекватного лечения приводит к необратимой инвалидизации.
Дифференциальная диагностика ОАП в острой фазе включает два основных вопроса:
- Являются ли воспалительные изменения следствием поражения костных структур или их следует рассматривать как проявление другого заболевания (флегмоны стопы, острого тромбофлебита, подагрического артрита, ревматических поражений суставов и др.)?
- При наличии рентгенографических признаков деструкции кости имеет она неинфекционную (ОАП) или инфекционную (остеомиелит) природу?
Для решения первого вопроса необходимы данные рентгенографии стоп (хотя в острой фазе могут присутствовать лишь неспецифические изменения в виде остеопороза). Магнитно-резонансная томография и сцинтиграфия скелета стопы выявляют микропереломы, воспалительные изменения, усиление кровотока в пораженных костях.
Возможна оценка биохимических маркеров распада костной ткани (гидроксипролина, дезоксипиридинолина, фрагментов коллагена и др.). С аналогичной целью могут использоваться и маркеры перестройки костной ткани, отражающие активность остеобластов (то есть остеосинтеза), - костный изофермент щелочной фосфатазы и др. Но уровень этих веществ во многом зависит от активности процессов распада костной ткани в скелете в целом.
Очевидно, что изменения, характерные для других заболеваний: признаки острого тромбофлебита при УЗДГ венозной системы, типичная клиника подагрического артрита (с болевым синдромом и лихорадкой, соответствующей рентгенологической и биохимической картиной) и прочие - делают диагноз ОАП менее вероятным. Для остальных случаев наиболее приемлемым на сегодняшний день алгоритмом диагностики ОАП в острой фазе можно считать следующий.
При возникновении у больного сахарным диабетом одностороннего отека стопы (особенно при неповрежденной коже) следует обязательно исключить возможность ОАП. При подозрении на ОАП и при повышенном риске ее развития (длительное течение сахарного диабета, выраженная диабетическая нейропатия) целесообразнее назначить лечение сразу, чем через несколько месяцев наблюдать необратимую деформацию стопы.
Второй вопрос чаще возникает при наличии трофической язвы стопы или в послеоперационном периоде после ампутации в пределах стопы или другого оперативного вмешательства. Это связано с тем, что остеомиелит при синдроме диабетической стопы чаще всего вторичный, являющийся осложнением трофической язвы или раневого процесса. В решении этого вопроса помогают данные анализа крови: нейтрофильный лейкоцитоз характерен (хотя и необязателен) для остеомиелита, но не для ОАП. Об остеомиелите свидетельствуют также некоторые рентгенологические признаки (реакция надкостницы), а также наличие свища, зондирование костных структур в дне раны. Эффективный, но малодоступный метод исследования - сцинтиграфия скелета с введением лейкоцитов с радиоактивной меткой. «Золотым стандартом» в определении природы деструкции костной ткани является биопсия кости.

Диабетическая артропатия
Гагик Радикович ГАЛСТЯН
ведущий научный сотрудник ГУ Эндокринологический научный центр РАМН
За последние 10 лет число больных сахарным диабетом возросло на 122%.
При таком темпе прироста число пациентов с нарушением углеводного обмена в 2015 г. превысит 300 млн человек. Очевидно, что это будет сопровождаться увеличением распространенности хронических осложнений сахарного диабета, в том числе частоты поражений нижних конечностей. Результаты эпидемиологических исследований свидетельствуют о том, что в структуре всех ампутаций нижних конечностей нетравматического характера больные сахарным диабетом составляют 50-70%. Анализ частоты ампутаций в зависимости от возраста, длительности заболевания, типа диабета показывает, что частота развития синдрома диабетической стопы выше у лиц пожилого возраста, причем с тенденцией к развитию гангрены и, следовательно, высокой частоте «больших» ампутаций (см. рис. 1)
Рис 1. - Количество и процентное соотношение ампутаций различного уровня у больных с СД и без СД
большая длительность заболевания определяет большую частоту осложнений со стороны стоп; несколько чаще развитие синдрома диабетической стопы имеет место у мужчин, больных сахарным диабетом 2-го типа (см. рис. 2).
Рис 2. - Частота госпитализации больных СД по поводу ампутации нижних конечностей согласно возрасту и полу
Определение «синдром диабетической стопы» объединяет патологические изменения периферической нервной системы, артериального и микроциркуляторного русла, костных структур, представляющие непосредственную угрозу развития язвенно-некротического процесса и гагрены конечности.
Нейропатия и ишемия являются основными факторами, приводящими к формированию • синдрома диабетической стопы (см. рис. 3).
Рис 3. - Анализ результатов этиологической оценки образования язв на стопе и голени
Снижение кровотока в магистральных артериях может привести к образованию язвенно-некротических изменений стоп у больного сахарным диабетом еще до развития критической ишемии. Это связано с наличием у данной категории пациентов сопутствующей дистальной диабетической полинейропатии.
В то же время только тяжелая нейропатия, при которой имеет место полное отсутствие чувствительности стоп, еще недостаточное условие для образования язвенных дефектов стоп. Как правило, непосредственной причиной нарушения целостности кожи или формирования язвы являются повреждающие воздействия внешней среды.
Соматическая, длительно протекающая сенсомоторная нейропатия приводит к характерной деформации стопы, препятствующей нормальному расположению ее при ходьбе и стоянии (см. рис. 4).
Рис 4. - Деформация пальцев стопы у больного с диабетической нейропатией
Проекции головок плюсневых костей
При такой деформации следует ожидать появления язв в одной (или нескольких) из «зон риска» (указаны стрелками), на которые приходится избыточное давление при ходьбе или ношении тесной обуви.
Моторная нейропатия обусловливает нарушение баланса между сухожилиями сгибателями-разгибателями, приводит к клювовидным деформациям, выбуханию головок плюсневых костей, формированию отдельных участков на подошвенной поверхности стопы, испытываюпщх избыточное нагрузочное давление. Постоянное давление на эти области ведет к утолщению эпидермиса с образованием участков гиперкератоза с последующим воспалительным аутолизом мягких тканей и формированию язвы. Это и есть одна из причин наиболее частого расположения язв именно в области проекции головок плюсневых костей на подошве (см. рис. 5),
Рис 5. - Характерный вид нейропатической язвы (язва окружена гиперкератозом) - расположена в зоне повышенного подошвенного давления
в отличие от ишемических язв, располагающихся в краевых зонах стопы (см. рис. 6).
Снижение болевой чувствительности и проприоцепции приводит к тому, что образование язвы остается больным незамеченным. Часто из-за сниженной чувствительности пациенты лишены защиты от воздействия различных повреждающих воздействий внешней среды, например действия высоких температур. Автономная дисфункция, часто сопутствующая соматической нейропатии, характеризуется снижением или полным отсутствием функции потоотделения, следствием чего является сухая, истонченная кожа. Результатом вегетативной нейропатии, которую можно охарактеризовать как своеобразную аутосимпатэктомию, является обызвествление медии артерий (артерио-лосклероз Менкеберга). Это проявление вегетативной нейропатии имеет место у 25% больных сахарным диабетом, легко определяется рентгенографически и нередко ошибочно трактуется как наличие у пациента облитерирую-щего атеросклероза. В действительности же обызвествление медии сосудов не обусловлено атеросклерозом. Вместе с этим оно приводит к изменению эластичности стенок сосудов и может явиться причиной диагностических ошибок при проведении допплерометрии (ложно повышенные показатели систолического давления в артериях голени). Вазомоторная нейропатия при диабете приводит к усилению кровотока в поверхностных кожных сосудах, что обусловливает повышенную температуру кожных покровов стоп, усиленному кровенаполнению и контурированию вен даже в горизонтальном положении пациента.
Эти изменения являются следствием образования множества артериовенозных шунтов, по которым артериальная кровь, минуя капиллярную сеть, сбрасывается в венозное русло, приводя к фактическому снижению капиллярного кровотока. Поскольку снижение функции периферической нервной системы носит постепенный характер, в большинстве случаев оно остается незамеченным пациентом. На стадии тяжелой полинейропатии активная симптоматика может отсутствовать. Таким образом, объективная оценка состояния периферической нервной системы у больных сахарным диабетом имеет принципиально важное значение как для врача, так и для пациента. Именно во время обследования он впервые может узнать о сниженной чувствительности на стопах.
Диабетическая макроангиопатия
Указаний на специфически "диабетическую" природу поражения крупных сосудов или существование «диабетического атеросклероза» до сих пор нет. Однако диабет явно ускоряет атеросклеретический процесс, который обычно связан с возрастом. Это влияние можно наблюдать не только при диабете, но и при нарушении толерантности к углеводам. И наоборот, другие сердечно-сосудистые факторы риска, такие как гиперлипидемия и гипертония, очевидно, ускоряют манифестацию диабета через усиление инсулинорези-стентности. У многих пациентов повышенный риск атеросклероза, скорее всего, берет начало еще на стадии нарушенной толерантности к углеводам. В результате оказывается, что ко времени установления диагноза «сахарный диабет 2-го типа» у человека уже имеются проявления макроангиопатии. Атеросклеротиче-ский процесс носит диффузный характер, имеется выраженное предрасположение к поражению периферических артериальных сегментов. Наличие сопутствующей нейропатии может обусловливать бессимптомный характер течения хронических облитерирующих заболеваний артерий нижних конечностей. Синдром перемежающейся хромоты у больных сахарным диабетом и пациентов с ХОЗАНК встречается лишь в 15% случаев, а боли покоя на стадии критической ишемии конечности только в 50%.
Рис. 6. - Акральны и некроз у больной с нейроишемической формой СДС
Диагностика поражений стоп в амбулаторных условиях
Основная задача диагностических мероприятий на доклиническом этапе обследования больного с поражениями нижних конечностей и сахарным диабетом - в максимально ранние сроки определить клиническую форму синдрома диабетической стопы. Для этого необходимо провести общее клиническое исследование (жалобы, анамнез, осмотр стоп), использовать инструментальные методы исследования (определение тактильной и вибрационной чувствительности, измерение систолического давления в артериях голени или пальцевой артерии с подсчетом лодыжечно-плече-вого или пальце-плечевого индекса, рентгенография стоп).
Дифференциальная диагностика нейропатической и ишемической формы синдрома диабетической стопы, исходя из данных анамнеза
Дифференциальная диагностика нейропатической и ишемической формы синдрома диабетической стопы, исходя из результатов осмотра ног
*При сопутствующей тяжелой нейропатии симптомы ишемии могут отсутствовать (см. выше).
Наиболее простым и эффективным методом выявления поражений стопы является осмотр ног. При этом важно обратить внимание на такие признаки, как цвет конечности, наличие деформаций и отеков, состояние ногтевых пластинок, наличие участков гиперкератоза и их расположение, наличие язвенных дефектов, особенно в межпальцевых промежутках, остающихся незамеченными пациентами; пальпа-торно - определение пульсации на артериях стопы, состояние кожи и волосяного покрова.
Оценка состояния периферической чувствительности.
Исследование вибрационной чувствительности проводится с помощью градуированного
камертона. Для нейропатического поражена характерно повышение порога вибрационной чувствительности (см. рис. 7).
Рис. 7. - Исследование порога вибрационной чувствительности с помощью градуированного камертона
Показатель шкалы камертона ниже 3 баллов являются основанием для причисления пациента к групп высокого риска образования язвенного дефекта стопы.
Определение болевой, тактильной и температурной чувствительности по стандартным методикам. Наиболее распространенным является определение тактильной чувствительности с помощью 10 г монофиламента (см. рис. 8). Эта методика приведена в качестве скрининговой в Международном консенсусе по диабетической стопе (Нидерланды, 1999).
Оценка состояния артериального кровотока. Наиболее часто используются неинвазивные методы оценки состояния периферического кровотока - допплерометрия, допплерография. Проводится измерение систолического давления в артериях бедра, голени и стопы, по градиенту давления определяется уровень окклюзии. Показатели лодыжечно-плечевого индекса (ЛПИ) отражают степень снижения артериального кровотока. ЛПИ вычисляется как отношение величины систолического АД в артерии голени или стопы к величине систолического АД в плечевой артерии. ЛПИ < 0,9 свидетельствует о снижении магистрального кровотока, ЛПИ < 0,5 - о критическом снижении кровотока.
Показатели систолического давления и ЛПИ определяют дальнейший ход диагностического поиска. Показатели систолического давления могут служить определенным ориентиром в плане возможности консервативного лечения (при САД > 70-90 мм рт. ст.), они также позволяют прогнозировать вероятность заживления язвенных дефектов стоп.
Рентгенография стоп и голеностопных суставов.
Этот метод исследования позволяет выявить признаки диабетической остеоартропа-тии, диагностировать спонтанные переломы мелких костей стопы, заподозрить наличие остеомиелита, исключить или подтвердить развитие газовой гангрены. Характерными рентгенологическими признаками диабетической остеоартропатии являются остеопороз и остеолиз с преимущественной локализацией в костях предплюсны и плюсны, параоссаль-ные обызвествления, подвывихи и вывихи суставов, фрагментация костей (см. рис. 9).
Рис 9. - Рентгенологическая картина диабетической ретинопатии
В мягких тканях стоп и голеней можно заметить обызвествленные артерии (артериоло-склероз Менкеберга).
Как правило, решение о дополнительных исследованиях состояния артериального и венозного русла нижних конечностей принимают совместно эндокринолог, терапевт и ангио-хирург. Ультразвуковое допплерографическое исследование, а желательно и дуплексное сканирование выполняется пациентам с облитерирующим поражением артерий нижних конечностей. В случае, если планируется хирургическая артериальная реконструкция, необходимо выполнить рентгеновскую ангиографию. Эти методы позволят точно определить локализацию, протяженность и степень артериальной окклюзии, вовлеченность рядом расположенных артериальных стволов, что, в свою очередь, влияет на выработку тактики оперативного вмешательства. Подробное изучение состояния периферического кровотока должно проводиться и пациентам с предполагаемым сопутствующим заболеванием венозной системы конечностей (варикозное расширение вен, тромбофлебит, посттромбофлебитический синдром).
В случае, если у больного имеется нейроишемическая или ишемическая форма синдрома диабетической стопы с длительно незаживающим язвенным дефектом, показано проведение транскутанного определения насыщения кислородом тканей. Эта неинвазивная методика позволит оценить степень ишемии тканей, сделать правильный выбор между консервативным и оперативным методом лечения. Зная степень насыщения кислородом, можно точнее прогнозировать эпителизацию язвенного дефекта.
Компьютерная и магнитно-резонансная томография - методы исследования, получившие широкое распространение в последние годы. Отмечена их высокая диагностическая ценность в проведении дифференциальной диагностики таких состояний, как диабетическая остеоартропатия и остеомиелит, особенно при небольших очагах поражения и нечеткой клинической картине. Использование этих методик позволяет избежать необоснованных ампутаций конечности и более эффективно проводить лечение нейропатических язвенных дефектов у больных со стопой Шарко.
При наличии язвенных дефектов, особенно обширных, длительно незаживающих и склонных к рецидивированию, необходимым является бактериологический анализ раневого отделяемого, проводимый как исходно, так и в ходе антибактериального лечения.
При нейропатической форме синдрома диабетической стопы рекомендован следующий комплекс лечебных мероприятий.
Компенсация сахарного диабета (нор-могликемия и аглюкозурия в течение суток, пикированный гемоглобин HbAlc не более 7%).
Разгрузка пораженной конечности (разгрузочная обувь, кресло-каталка, костыли, индивидуальная разгрузочная повязка).
Подбор адекватной антибактериальной терапии с учетом чувствительности выделенной микрофлоры.
Использование современных перевязочных средств в соответствии с фазой раневого процесса.
Методы разгрузки пораженной конечности.
Учитывая данную особенность локализации язвенных дефектов на подошвенной поверхности стоп, одним из необходимых условий успешного консервативного лечения становится создание режима максимальной разгрузки пораженной конечности. С этой целью используется либо специальная индивидуальная разгрузочная повязка (ИРП), либо лечебно-разгрузочная обувь. Применение лечебной обуви возможно только в том случае, если язвенный дефект расположен в передней части одной стопы (см. рис. 10).
Рис. 10 - Обувь для разгрузки переднего отдела стопы
Предназначена для освобождения от нагрузки переднего отдела стопы при язвах, ранах, травмах. Можно использовать как в хирургических отделениях, так и в эндокринологических у лиц с синдромом диабетической стопы и язвах на передних отделах стопы
При локализации дефекта в пяточной области или при двустороннем поражении использование этого способа разгрузки невозможно. В таких случаях разгрузка конечности осуществляется с помощью ИРП (см. рис. 11).
В отделении диабетической стопы ЭНЦ РАМН разработана методика создания индивидуальной разгрузочной повязки с использованием современных синтетических полимерных материалов Softcast и Scotchcast Повязки были применены у пациентов с нейропатиче-скими язвами пяточной области и средней части стопы, а также в острой стадии диабетической остеоартропатии.
В случае нейроишемической формы синдрома диабетической стопы лечение проводится консервативно (если нет критической ишемии).
Компенсация сахарного диабета (нор-могликемия и аглюкозурия в течение суток, пикированный гемоглобин HbAlc не более 7%).
Устранение нарушений липидного обмена, гемокоагуляции и артериальной гипер-тензии.
Консультация у ангиохирурга для решения вопроса о возможности хирургической реконструкции сосудистого русла.
Разгрузка пораженной конечности.
Подбор адекватной антибактериальной терапии с учетом чувствительности выделенной микрофлоры.
Местный контроль за состоянием раны.
При наличии критической ишемии решается вопрос о возможности проведения рекоструктивнои сосудистой операции или восстановлении кровотока с использованием методики чрескожной баллонной ангио-пластики (см. рис. 12).
Меры профилактики поражений нижних конечностей
Рис. 12. - Баллонная ангиопластика у больного с окклюзией задней тибиальной артерии с устранением явлений ишемии (Предоставлено ЕРОШКИНЫМ И.А.)
Для профилактики синдрома диабетической стопы необходимо проанализировать факторы, приводящие к поражению стоп. Благоприятствующим условием для поражения нижних конечностей является хроническая декомпенсация СД, приводящая к диабетической нейропатии и ангиопатии. В связи с этим первичная профилактика поражений стоп состоит в достижении и поддержании близкого к нормальному уровня гликемии, целевых значений артериального давления и показателей липидов крови.
Здесь роль врача-интерниста чрезвычайно важна. При наличии факторов риска поражения стоп (нарушение чувствительности, снижение магистрального кровотока, деформация стопы и т.д.) больного следует направить в специализированный кабинет диабетической стопы, где будет осуществляться комплекс мер по вторичной и третичной профилактике образования язв и гангрены стопы. Спонтанный некроз кожи возможен лишь при критической ишемии нейроишемической формы поражения. Доля таких больных составляет лишь 5-10% от числа всех пациентов с синдромом диабетической стопы. При нейропатической форме для развития трофической язвы или иного деструктивного процесса необходим пусковой фактор - небольшое и часто не замечаемое пациентом повреждение тканей. Это повреждение может быть как однократным (травма острым предметом, ожог), так и длительно действующим (сдавление тесной обувью, инородный предмет в обуви, аномальное распределение нагрузок на стопу вследствие ее деформации). Такая травма часто является пусковым фактором и при ишемической форме синдрома диабетической стопы, когда еще нет критического снижения кровообращения.
В подавляющем большинстве случаев такие повреждения, а стало быть новые случаи синдрома диабетической стопы, гангрену и ампутацию можно предотвратить с помощью обучения пациента специальным правилам поведения. Для этого в структурированную программу лечения и обучения в обязательном порядке включают занятия, посвященные профилактике поражений стоп. Пациенты должны получать эту информацию (правильную и в полном объеме) и от лечащего врача-эндокринолога, интерниста, хирурга и т.д. С вопросами об уходе за ногами, предотвращении и лечении поражений нижних конечностей при сахарном диабете пациенты обращаются не только в кабинет диабетической стопы, а чаще к врачам других специальностей. Поэтому все они должны быть способны дать больному диабетом грамотные и всеобъемлющие рекомендации, направленные на сохранение нижних конечностей, предотвращение синдрома диабетической стопы, гангрены и ампутации.
Диабетическая стопа
Diabetic foot - MRI examination
by Ivo Schoots, Mario Maas and Robin Smithuis
Radiology department of the AMC in Amsterdam and the Rijnland hospital in Leiderdorp, the Netherlands
Пациент давно болен сахарным диабетом, направлен на рентгенографию обеих стоп.
Внешний вид.
МРТ. Диабетическая стопа
http://www.radsource.us/clinic/1308